簡介
 吉布斯自由能
吉布斯自由能G=U−TS+pV=H−TS,其中U是系統的內能,T是溫度,S是熵,p是壓強,V是體積,H是焓。
吉布斯自由能的微分形式是:
dG=−SdT+Vdp+μdN,其中μ是化學勢,也就是說每個粒子的平均吉布斯自由能等於化學勢。
提出
1876年美國著名數學物理學家,數學化學家吉布斯在康乃狄克科學院學報上發表了奠定化學熱力學基礎的經典之作《論非均相物體的平衡》的第一部分。1878年他完成了第二部分。這一長達三百餘頁的論文被認為是化學史上最重要的論文之一,其中提出了吉布斯自由能,化學勢等概念,闡明了化學平衡、相平衡、表面吸附等現象的本質。
原理
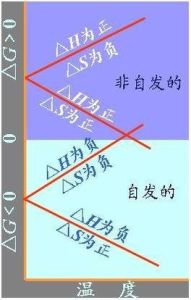
等溫、等壓的封閉體系內,不作非體積功的前提下,任何自發反應總是朝著吉布斯自由能(G)減小的方向進行。ΔG=0時,反應達平衡,體系的G降到最小值。
定義
ΔG=ΔH-TΔS(Kj/mol)
G叫做吉布斯自由能。因為H、T、S均為狀態函式,所以G為狀態函式。
特點
ΔG叫做吉布斯自由能變,吉布斯自由能的變化可作為恆溫、恆壓過程自發與平衡的判據。
吉布斯自由能改變數。表明狀態函式G是體系所具有的在等溫等壓下做非體積功的能力。反應過程中G的減少量是體系做非體積功的最大限度。這個最大限度在可逆途徑得到實現。反應進行方向和方式判據。
等溫公式
 吉布斯自由能
吉布斯自由能ΔG=ΔG0+RT·lnJ
其中,ΔG0是同一溫度、標準壓強下的吉布斯自由能,R是氣體常數,J是反應熵。
溫度的變化在ΔG0的使用上表現出來,不同的溫度使用不同的ΔG0。非標準狀況的ΔG0需要通過定義式(即吉布斯等溫公式)計算。壓強或濃度的變化在J的表達上表現出來。
物理意義
 吉布斯自由能
吉布斯自由能定義吉布斯自由能G=H-TS。因為H、T、S均為狀態函式所以G為狀態函式。
吉布斯自由能改變數-ΔG=-(G2-G1)>=W非。表明狀態函式G是體系所具有的在等溫等壓下做非體積功的能力。反應過程中G的減少量-ΔG是體系做非體積功的最大限度。這個最大限度在可逆途徑得到實現。反應進行的方向和方式可以由ΔG進行判斷:
-ΔG>W非反應以不可逆方式自發進行
-ΔG=W非反應以可逆方式進行
-ΔG
若反應在等溫等壓下進行,不做非體積功,即W非=0則
ΔG<0自發進行
ΔG=0不能進行
ΔG>0逆反應自發進行
可見等溫等壓下體系的吉布斯自由能減小的方向是不做非體積功的化學反應進行的方向。
任何等溫等壓下不做非體積功的自發過程的吉布斯自由能都將減少。
自由能
在溫度T時,當反應物和生成物都處於標準態,發生反應進度為1mol的化學反應Gibbs自由能的變化值,稱為標準摩爾反應吉布斯自由能變化值,用來表示標準吉布斯自由能與一般反應的吉布斯自由能的關係:
平衡常數
 吉布斯自由能
吉布斯自由能ΔG0=-RT ln K
要注意,使用范特霍夫等溫公式時,ΔG和ΔG0的溫度一定要相等。
這樣,我們可以推出以下結論:
ΔG0>0時,K<1;
ΔG0=0時,K=1;
ΔG0<0時,K>1。