歷史起源
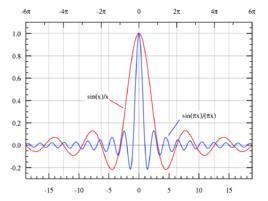
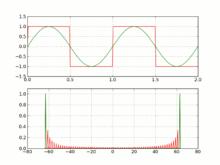 圖1.吉布斯現象示意圖
圖1.吉布斯現象示意圖數學界有過一場“正弦曲線能否組合成一個帶有稜角的信號”的爭議,這場爭議的男主角分別是傅立葉和拉格朗日。
直到1898年,美國人阿爾伯特·米切爾森做了一個諧波分析儀, 當他測試方波時驚訝的發現方波的XN(t)在不連續點附近部分呈現起伏,這個起伏的峰值大小似乎不隨N增大而下降。於是他寫信給當時著名的數學物理學家吉布斯,吉布斯檢查了這一項結果,隨即發表了他的看法:隨著N增加,部分起伏就向不連續點壓縮,但是對任何有限的N值,起伏的峰值大小保持不變,這就是吉布斯現象。
吉布斯現象示意圖如圖所示。
Gibbs 現象
解釋
圖像的傅立葉變換 ,由於其變換本身有多種成熟的快速算法(FFT算法),而且性能接近於最佳,從而獲得較早的也比較廣泛的研究。它的不足之處在於:相鄰子圖像數據在各個邊界不連續造成的所謂Gibbs現象。這是由於圖像數據的二維傅立葉變換實質上是一個二維圖像的傅立葉展開式。這個二維圖像應被認為是周期性的。由於子圖像的變換係數在邊界不連續 ,而將造成復原的子圖像在其邊界也不連續 。於是由復原子圖像構成的整幅復原圖像將呈現隱約可見的以子圖像尺寸為單位的方塊狀結構,影響整個圖像質量。當子圖像尺寸較小時更為嚴重。
解決方法
解決這個Gibbs現象的方法是後來研究出來的二維餘弦變換(DCT)代替二維傅立葉變換。基本思路為:用一個對稱的2N*2N 像素的子圖像代替原來N*N 子圖像。由於對稱性, 子圖像作二維傅立葉變換,其變換係數將只剩下實數的餘弦項。這樣,即可消除Gibbs現象。
套用
概述
當體系發生變化時,G也隨之變化。其改變值△G,稱為體系的吉布斯自由能變,只取決於變化的始態與終態,而與變化的途徑無關:△G=G終一G始 按照吉布斯自由能的定義,可以推出當體系從狀態1變化到狀態2時,體系的吉布斯自由能變為:△G=G2一Gl=△H一△(TS) 對於等溫條件下的反應而言,有T2=T1=T 則 △G=△H一T △S 上式稱為吉布斯一赫姆霍茲公式(亦稱吉布斯等溫方程)。由此可以看出,△G包含了△H和△S的因素,若用△G作為自發反應方向的判據時,實質包含了△H和△S兩方面的影響,即同時考慮到推動化學反應的兩個主要因素。因而用△G作判據更為全面可靠。而且只要是在等溫、等壓條件下發生的反應,都可用△G作為反應方向性的判據,而大部分化學反應都可歸人到這一範疇中,因而用△G作為判別化學反應方向性的判據是很方便可行的。
作為判據套用
化學反應自發性判斷:考慮ΔH和ΔS兩個因素的影響,可分為以下四種情況:
ΔH<0,ΔS>0;ΔG<0正向自發。
ΔH>0,ΔS<0;ΔG>0正向非自發。
ΔH>0,ΔS>0;升溫至某溫度時,ΔG由正值變為負值,高溫有利於正向自發。
ΔH<0,ΔS<0;降溫至某溫度時,ΔG由正值變為負值,低溫有利於正向自發。
1.ΔH<0,ΔS>0;ΔG<0正向自發。
2.ΔH>0,ΔS<0;ΔG>0正向非自發。
3.ΔH>0,ΔS>0;升溫至某溫度時,ΔG由正值變為負值,高溫有利於正向自發。
4.ΔH<0,ΔS<0;降溫至某溫度時,ΔG由正值變為負值,低溫有利於正向自發。