概述
 吉布斯函式
吉布斯函式 按照吉布斯自由能的定義,可以推出當體系從狀態1變化到狀態2時,體系的吉布斯自由能變為:△G=G2一Gl=△H一△(TS)
對於等溫條件下的反應而言,有T2=T1=T
則△G=△H一T △S
上式稱為吉布斯一赫姆霍茲公式(亦稱吉布斯等溫方程)。由此可以看出,△G包含了△H和△S的因素,若用△G作為自發反應方向的判據時,實質包含了△H和△S兩方面的影響,即同時考慮到推動化學反應的兩個主要因素。因而用△G作判據更為全面可靠。而且只要是在等溫、等壓條件下發生的反應,都可用△G作為反應方向性的判據,而大部分化學反應都可歸入到這一範疇中,因而用△G作為判別化學反應方向性的判據是很方便可行的。
如果一個封閉系統經歷一個等溫定壓過程,則有:
ΔG≤W′(2)式中ΔG為此過程系統的吉布斯函式的變化值,W′為該過程中的非體積功,不等號表示該過程為不可逆過程,等號表示該過程為可逆過程。式(2)表明,在等溫定壓過程中,一個封閉系統吉布斯函式的減少值等於該系統在此過程中所能做的最大非體積功。
如果一個封閉系統經歷一個等溫定壓且無非體積功的過程,則根據式(2)可得:
ΔG≤0(3)式(3)表明,在封閉系統中,等溫定壓且不作非體積功的過程總是自動地向著系統的吉布斯函式減小的方向進行,直到系統的吉布斯函式達到一個最小值為止。因此,在上述條件下,系統吉布斯函式的變化可以作為過程方向和限度的判斷依據,尤其是在相平衡及化學平衡的熱力學研究中,吉布斯函式是一個極其有用的熱力學函式。
作為判據套用
化學反應自發性判斷:
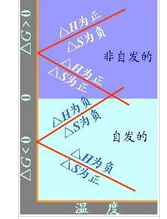
考慮ΔH和ΔS兩個因素的影響,可分為以下四種情。
1)ΔH<0,ΔS>0;ΔG<0正向自。
2)ΔH>0,ΔS<0;ΔG>0正向非自。
3)ΔH>0,ΔS>0;升溫至某溫度時,ΔG由正值變為負值,高溫有利於正向自。
4)ΔH<0,ΔS<0;降溫至某溫度時,ΔG由正值變為負值,低溫有利於正向自發。
提出
1876年美國著名數學物理學家,數學化學家吉布斯在康乃狄克科學院學報上發表了奠定化學熱力學基礎的經典之作《論非均相物體的平衡》的第一部分。1878年他完成了第二部分。這一長達三百餘頁的論文被認為是化學史上最重要的論文之一,其中提出了吉布斯自由能(又叫吉布斯函式),化學勢等概念,闡明了化學平衡、相平衡、表面吸附等現象的本質。

