發現
1818年,L.J.Thenard發現水系無機物、有機物在自動氧化時,或者在生物體內呼吸氧氣時,在生成水之前會生成過氧化氫。性質
化學性質
1、氧化性(油畫中鉛白[鹼式碳酸鉛]會與空氣中的硫化氫反應生成黑色硫化鉛,就可套用過氧化氫洗滌)
原理:硫化鉛→氧化鉛→鹼式碳酸鉛
(需要鹼性介質)
2、還原性:和氯氣、高錳酸鉀等強氧化劑反應被氧化生成氧氣。
3、在10%試樣液10mL中,加稀硫酸試液(TS-241)5mL和高錳酸鉀試液(TS-193)1mL。應有氣泡發生,且高錳酸鉀的紫紅色消失。對石蕊呈酸性。遇有機物易爆。
4、取試樣1g(準確至0.1mg),用水稀釋至250.0mL。取此溶液25mL,加10mL稀硫酸試液(TS-241)後用0.1mol/L高錳酸鉀滴定。每毫升0.1mol/L。高錳酸鉀相當於過氧化氫(H2O2)1.70mg。
5、遇有機物、受熱分解放出氧氣和水,遇鉻酸、高錳酸鉀、金屬、碳酸反應劇烈。為了防止分解,可以加入微量的穩定劑,如錫酸鈉、焦磷酸鈉等等。
6、過氧化氫是一種極弱的酸:H2O2=(可逆)=H++HO2-(Ka=2.4×10-12)。因此金屬的過氧化物可以看做是它的鹽。
7、純過氧化氫很不穩定,加熱到153°C便猛烈的分解為水和氧氣。
催化劑
體內的過氧化氫酶(Catalase)可以催化雙氧水的分解反應,使其釋放出氧氣,轉化為對機體無毒的水。
物理性質
主要成分:工業級分為27.5%、35%兩種。
氣味:有微弱的特殊氣味。純過氧化氫是淡藍色的油狀液體。
折射率:1.4067(25℃)
飽和蒸氣壓(kPa):0.13(15.3℃)
密度:1.13(g/mL,20°C)
熔點:-11℃
水溶液為無色透明液體,溶於水、醇、乙醚,不溶於苯、石油醚。
純過氧化氫是淡藍色的粘稠液體,熔點-0.43°C,沸點150.2°C,純的過氧化氫其分子構型會改變,所以熔沸點也會發生變化。凝固點時固體密度為1.71g/cm³,密度隨溫度升高而減小。它的締合程度比H2O大,所以它的介電常數和沸點比水高。
化學反應
過氧化氫是非常強的氧化劑,它和其他氧化劑的標準電極電勢值列在右面,值越高代表氧化性越強。分解反應
過氧化氫可自發分解歧化生成水和氧氣:ΔHo為-98.2kJ·mol-1,ΔGo為-119.2kJ·mol-1,ΔS為70.5J·mol-1·K-1。重金屬離子Fe2+、Mn2+、Cu2+等對過氧化氫的分解有催化作用。過氧化氫在酸性和中性介質中較穩定,在鹼性介質中易分解。用波長為320~380nm的光照射會使過氧化氫分解速度加快,故過氧化氫應盛於棕色瓶中並放在陰涼處。
H2O2與Fe2+的混合溶液稱為芬頓試劑(Fenton)。某些離子如Fe2+、Ti3+催化下,過氧化氫分解反應會生成自由基中間體HO·(羥基自由基)和HOO·。
一般使用的雙氧水中都會含有一定量的穩定劑,以減少過氧化氫的分解。常用的穩定劑包括:錫酸鈉、焦磷酸鈉和有機亞磷酸酯。
氧化還原反應
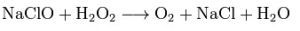 化學反應
化學反應過氧化氫可在水溶液中氧化或還原很多無機離子。用作還原劑時產物為氧氣,用作氧化劑時產物為水。例如酸性溶液中,過氧化氫可將Fe2+氧化為Fe3+:與過氧化氫作用,亞硫酸根(SO32-)可被氧化為硫酸根(SO42-),高錳酸鉀在酸性溶液中會被還原為Mn2+。由於標準電極電勢的緣故,反應在不同pH環境下進行的方向可能不同,如鹼性溶液中,過氧化氫會將Mn2+氧化為MnIV,以MnO2形式生成。
過氧化氫還原次氯酸鈉的反應可用於在實驗室中製備氧氣;有機化學中,過氧化氫常用作氧化劑,可將硫醚氧化為亞碸。甲基苯基硫醚與其反應時,會被氧化為甲基苯基亞碸,以甲醇作溶劑或三氯化鈦催化,產率為99%;
過氧化氫的鹼性溶液可用於富電子烯烴(如丙烯酸)的環氧化反應,以及在硼氫化-氧化反應第二步中氧化烷基硼至醇。
生成過氧化物
 化學反應
化學反應過氧化氫與很多無機或有機化合物反應時,過氧鏈保留並轉移到另一分子上,生成新的過氧化物;
過氧化氫在低溫下與鉻酸或重鉻酸鹽酸性溶液反應時,會生成不穩定的藍色過氧化鉻CrO(O2)2,可用乙醚或戊醇萃取。水溶液中過氧化鉻很快分解為氧氣和含鉻離子。
過氧化氫與硼砂反應會生成過硼酸鈉,可用作消毒劑;
過氧化氫可生成很多含有O22-過氧根離子的無機鹽類,其中比較重要的如過氧化鈣、過氧化鈉和過氧化鎂。
與羧酸(RC=O-OH)反應,生成具氧化性的過氧酸(RC=O-O-OH),可用於烯烴環氧化反應等用途。與丙酮反應生成炸藥三過氧化三丙酮(TATP),與臭氧反應生成三氧化二氫,與尿素反應生成過氧化尿素。
過氧化氫與三苯基氧化膦生成酸鹼加合物,有些反應中用作過氧化氫的等同試劑。
鹼性
與水相比,過氧化氫的鹼性要弱得多,只有與很強的酸反應才會生成加合物。超強酸HF/SbF5可將過氧化氫質子化,生成含[H3O2]+離子的產物。工業製法
製法一
生產鹼性過氧化氫的空氣電極及其製法。
此方法屬於用電化學方法製備無機化合物的領域,涉及工業製備鹼性過氧化氫用含醌空氣電極及其製法。此方法多組元電極組由單元極板組裝,每對電極由陰極板,含醌空氣陰極碳芯、離子交換隔膜,塑膠支撐網與陽極板組成,在電極工作區的上下端設有流體分配室和收集室,在流體進口處設有節流孔,多組元電極採用有限制的偶極串聯,將陽極循環鹼水所用塑膠軟管延長至5米以上。可以在直接使用低壓空氣的情況下製備鹼性過氧化氫並得到滿意的工作指標,不存在電極受鹼水浸透而失效的缺點。生產鹼性過氧化氫用含醌空氣電極,其特徵在於每對電極由陽極板、塑膠網、陽離子隔膜和含醌空氣陰極組成,在電極工作區的上、下端設有進入流體的分配室和排出流體的收集室,在流體進口處設有節流孔,多組元電極採用有限制的偶極串聯接法,加長陽極循環鹼水進、出口用的塑膠軟管後再接至集液總管,多組元電極組由單元極板組裝。
製法二
此方法涉及無機化合物製備領域,特別涉及從申請號為87103988專利申請中所得陰極產物的過氧化鈉水溶液製備過氧化氫的方法。用磷酸或磷酸二氫鈉將過氧化鈉水溶液中和至pH9.0~9.7,使生成Na2HPO4和H2O2,將所說的Na2HPO4和H2O2水溶液冷卻到+5~-5℃,使絕大部分Na2HPO4以Na2HPO4·10H2O水合物形式析出,再在離心分離器中將含有Na2HPO4·10H2O水合物和過氧化氧水溶液混合物進行分離,分離出該水合物,隨後再對含有少量Na2HPO4的過氧化氫水溶液進行蒸發和分餾,得到約30%H2O2產品。
製法三
用電解60%的硫酸,得到過二硫酸,再經水解可得濃度為95%的雙氧水。
套用
消毒
雙氧水是無色有刺激性氣味的液體。醫療上常用3%的雙氧水進行傷口或中耳炎消毒。當它與皮膚、口腔和黏膜的傷口、膿液或污物相遇時,立即分解生成氧。這種尚未結合成氧分子的氧原子,具有很強的氧化能力,與細菌接觸時,能破壞細菌菌體,殺死細菌。殺滅細菌後剩餘的物質是無任何毒害、無任何刺激作用的水。不會形成二次污染。因此,雙氧水是傷口消毒理想的消毒劑。但需要注意的是,不能用濃度大的雙氧水進行傷口消毒,以防灼傷皮膚及患處。工業套用
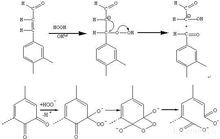 過氧化氫漂白機理
過氧化氫漂白機理其他套用
化學工業用作生產過硼酸鈉、過碳酸鈉、過氧乙酸、亞氯酸鈉、過氧化硫脲等的原料,酒石酸、維生素等的氧化劑。醫藥工業用作殺菌劑、消毒劑,以及生產福美雙殺蟲劑和40l抗菌劑的氧化劑。
印染工業用作棉織物的漂白劑,還原染料染色後的發色劑。用於生產金屬鹽類或其他化合物時除去鐵及其他重金屬。也用於電鍍液,可除去無機雜質,提高鍍件質量。還用於羊毛、生絲、皮毛、羽毛、象牙、豬鬃、紙漿、脂肪等的漂白。高濃度的過氧化氫可用作火箭動力燃料。
民用:處理廚房下水道的異味,到藥店購買雙氧水加水加洗衣粉倒進下水道,可去污,消毒,殺菌。
注意事項
1、不得口服,應置於兒童不易觸及處。
2、對金屬有腐蝕作用,慎用。
3、避免與鹼性及氧化性物質混合。
4、避光、避熱,置於常溫下保存。
5、醫用的有效期一般為2個月。
6、不得用手觸摸。
危險性
有毒性
吸入雙氧水的蒸氣或霧會對呼吸道產生強烈刺激。眼直接接觸液體可致不可逆損傷甚至失明。口服中毒出現腹痛、胸口痛、呼吸困難、嘔吐、一時性運動和感覺障礙、體溫升高等。個別病例出現視力障礙、癲癇樣痙攣、輕癱。長期接觸本品可致接觸性皮炎。爆炸性
過氧化氫本身不燃,但能與可燃物反應放出大量熱量和氧氣而引起著火爆炸。過氧化氫在pH值為3.5~4.5時最穩定,在鹼性溶液中極易分解,在遇強光,特別是短波射線照射時也能發生分解。當加熱到100℃以上時,開始急劇分解。它與許多有機物如糖、澱粉、醇類、石油產品等形成爆炸性混合物,在撞擊、受熱或電火花作用下能發生爆炸。過氧化氫與許多無機化合物或雜質接觸後會迅速分解而導致爆炸,放出大量的熱量、氧和水蒸氣。大多數重金屬(如鐵、銅、銀、鉛、汞、鋅、鈷、鎳、鉻、錳等)及其氧化物和鹽類都是活性催化劑,塵土、香菸灰、碳粉、鐵鏽等也能加速分解。濃度超過74%的過氧化氫,在具有適當的點火源或溫度的密閉容器中,能產生氣相爆炸。
危險行為
飲用或以雙氧水灌腸,可能導致口腔或消化道的黏膜受侵蝕而導致發炎,嚴重時可能穿孔或出血。
注射雙氧水,將導致血栓,容易導致器官壞死,嚴重者將導致死亡。
基本上,任何的食品加工都禁用雙氧水。
危險處理
若發生泄漏,迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。儘可能切斷泄漏源。防止流入下水道、排洪溝等限制性空間。
小量泄漏:用砂土、蛭石或其它惰性材料吸收。也可以用大量水沖洗,洗水稀釋後放入廢水系統。
大量泄漏:構築圍堤或挖坑收容。噴霧狀水冷卻和稀釋蒸汽、保護現場人員、把泄漏物稀釋成不燃物。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。
儲存方法
 過氧化氫
過氧化氫相關術語
安全術語
S26Incaseofcontactwitheyes,rinseimmediatelywithplentyofwaterandseekmedicaladvice.
不慎與眼睛接觸後,請立即用大量清水沖洗並徵求醫生意見。
S36/37/39Wearsuitableprotectiveclothing,glovesandeye/faceprotection.
穿戴適當的防護服、手套和護目鏡或面具。
S45Incaseofaccidentorifyoufeelunwell,seekmedicaladviceimmediately(showthelabelwheneverpossible.)
若發生事故或感不適,立即就醫(可能的話,出示其標籤)。
風險術語
R22Harmfulifswallowed.
吞食有害。
R41Riskofseriousdamagetotheeyes.
對眼睛有很嚴重的傷害。
非法使用情況
用作食品添加劑
雙氧水為無色無味的液體,添加入食品中可分解放出氧,起漂白、防腐和除臭等作用。因此,部分商家在一些需要增白的食品如:水發食品的牛百葉和海蜇、魚翅、蝦仁、帶魚、魷魚、水果罐頭和麵製品等的生產過程中違禁浸泡雙氧水,以提高產品的外觀。少數食品加工單位將發霉水產乾品經浸泡雙氧水處理漂白重新出售或為消除病死雞、鴨或豬肉表面的發黑、淤血和霉斑,將這些原料浸泡高濃度雙氧水漂白,再添加人工色素或亞硝酸鹽加工後出售。過氧化氫可通過與食品中的澱粉形成環氧化物而導致癌症,特別是消化道癌症。另外,工業雙氧水含有的砷、重金屬等多種有毒有害物質更加嚴重危害食用者的健康。FAO和WHO根據其毒性試驗報告規定,過氧化氫僅限於牛奶防腐的緊急措施之用。中國《食品添加劑使用衛生標準》亦規定雙氧水只可在牛奶中限量使用,且僅限於內蒙古和黑龍江兩地,在其它食品中均不得有殘留。
案例
 過氧化氫非法使用
過氧化氫非法使用2012年5月,常州武進法院開庭審理了一起食品安全案件,作坊老闆劉某因犯生產、銷售偽劣產品罪獲刑。劉某使用發霉發黑的牛肚牛雜通過雙氧水煮泡、老母豬肉添加牛肉香精變身“五香牛肉叉燒”,並把這些有毒有害食品賣到常州以及無錫、蘇州各地。
2012年7月13日,長沙芙蓉區馬王堆海鮮水產批發市場的羅某夫婦,用雙氧水浸泡牛百葉、毛肚、魷魚等食品,製作出“水發貨”並對外進行銷售,一年時間就生產用雙氧水浸泡的有毒食品1萬餘公斤。法院開審這起刑事案件,以生產銷售有毒、有害食品罪當庭判處羅某等兩年至一年不等的有期徒刑。據了解,製作“水發貨”過程時,工人都特別注意,穿雨靴、戴手套,不讓身體的任何部位接觸加有雙氧水的水滴,因為“一旦溶液濺到衣服上就會馬上有個洞”,且全家人從來不食用這些食品。
2013年5月,南寧市警方曾在一窩點繳獲20多噸假冒偽劣鳳爪成品及雞爪、牛百葉、牛黃喉等走私原材料。而在這一窩點的冷藏庫里,民警發現其中一些原材料(雞爪)包裝袋上印製的包裝日期竟然是三四十年前,其中“資歷”最老的雞爪,包裝日期顯示封存於1967年。廣西防城港市公安局治安支隊副支隊長李劍敏介紹,浙江一帶的一些不法商人通過地下渠道走私入境,並在當地一些食品廠將一些來源不明、無生產日期、無保質期的凍品隱蔽加工,仿冒多種品牌。李劍敏說,走私入境的凍品往往含有大量細菌和污血,不法分子用過氧化氫等漂白劑浸泡,“一則殺菌延長保質期,二則可以去除表面的污漬,讓雞爪顯得又白又大。”據被抓獲的犯罪嫌疑人交代,如此泡製,通常1公斤雞爪可以泡出超過1.5公斤雞爪。
歷史事件
1934年7月16日,德國使用火箭發動機的過氧化氫爆炸,炸死三人。在第二次世界大戰中,納粹德國在集中營中的使用過氧化氫作為對人的致死試驗品。
在2005年7月7日7時49分的倫敦捷運爆炸案中,恐怖分子使用的炸藥是“過氧化氫炸藥”,俗稱“HMDT”,其原理是過氧化氫與可燃物反應放出大量熱量和氧氣而引起著火爆炸,造成52人死亡。
常見謠言
謠言:在做過氧化氫溶液制氧氣的實驗中誤將高錳酸鉀當成二氧化錳跟其混合,其結果是:反應速率和生成氧氣的量和沒有加高錳酸鉀時一樣
上述“習題”出自2013-2014學年江蘇省鹽城市東台市四灶鎮中學九年級(上)月考化學試卷(1月份)第11題
駁斥:高錳酸鉀可以直接與過氧化氫反應:2KMnO4+3H2O2====2KOH+2MnO2↓+2H2O+3O2↑(鹼性或中性環境) ,正確的實驗現象是:劇烈反應,釋放的氧氣量增加。從化學方程式中可以看出,3個H2O2生成3個O2,也就是氧氣是完全由H2O2產生的,與高錳酸鉀無關,但比自行分解出的O2要多。高錳酸鉀作為氧化劑參與反應中,影響了氧氣釋放量。

