簡介
 pH值試紙
pH值試紙pH值,亦稱氫離子濃度指數、酸鹼值,是溶液中氫離子活度的一種標度,也就是通常意義上溶液酸鹼程度的衡量標準。 這個概念在1909年由丹麥生物化學家SørenPeterLauritzSørensen首次提出。p代表德語Potenz,意思是力量或濃度,H(hydrogenion)代表氫離子(H+)。有時候pH也被寫為拉丁文形式的pondushydrogenii。如果某溶液所含氫離子的濃度為每升0.00001摩爾(mol/L),它的氫離子濃度指數就是5,計算方法為-lg[濃度值]。與其相反,如果某溶液的氫離子濃度指數為5,他的氫離子濃度為0.00001摩爾每升(mol/L),計算方法為10^(-濃度指數)。
通常情況下(25℃、298K左右),pH值越趨向於0表示溶液酸性越強,越趨向於14表示溶液鹼性越強,當pH<7的時候,溶液呈酸性,當pH>7的時候,溶液呈鹼性,當pH=7的時候,溶液為中性。pH值允許小於0,如鹽酸(10mol/L)的pH為−。由於實際中的溶液不是理想溶液,所以僅僅用H+濃度是不可以準確測量的,因此也無法準確計算得到溶液的pH。故而應當採用H+活度,即pH=-lgaH+=-lgγ·cH+。這樣從理論上講只要知道氫離子的活度aH+就可以得到溶液的準確pH。
在常溫下(25℃時),pH>7為鹼性pH<7為酸性。
積常數
為了便於理解和說明pH,首先闡述一下水的電離和水的離子積常數。
水的電離:水是一種極弱的電解質,可以發生微弱的電離,其電離方程式為:H2O+H2O≒H3O++OH-,簡寫為H2O≒H++OH-,是一個吸熱過程。水的電離受溫度影響,加酸加鹼都能抑制水的電離。水的電離是水分子與水分子之間的相互作用而引起的,因此極難發生。實驗測得,25℃時1L純水中只有1×10^(-7)mol的水分子發生電離。由水分子電離出的H+和OH-數目在任何情況下總相等。25℃時,純水中[H+]=[OH-]=1×10^(-7)mol/L.
水的離子積常數:[H+]·[OH-]=K(W),其中K(W)稱作水的離子積常數,簡稱水的離子積;[H+]和[OH-]是分別是指整個溶液中氫離子和氫氧根離子的總物質的量濃度.K(W)只隨溫度變化而變化,是溫度常數.如25℃,[H+]=[OH-]=1×10^(-7)mol/L,K(W)=1×10^(-14);100℃時,[H+]=[OH-]=1×10^(-6)mol/L,K(W)=1×10^(-12).
測量方法
有很多方法來測量溶液的pH值:
使用pH指示劑
 pH值
pH值在待測溶液中加入pH指示劑,不同的指示劑根據不同的pH值會變化顏色,根據指示劑的研究結果就可以確定pH值的範圍。滴定時,可以作精確的pH標準。
使用pH試紙
pH試紙有廣泛試紙和精密試紙,用玻棒沾一點待測溶液到試紙上,然後根據試紙的顏色變化並對照比色卡也可以得到溶液的pH值。但pH試紙不能夠顯示出油份的pH值,由於pH試紙以氫離子製成和以氫離子來量度待測溶液的pH值,但油中沒含有氫離子,因此pH試紙不能夠顯示出油份的pH值。
使用pH計
pH計是一種測量溶液pH值的儀器,它通過pH選擇電極(如玻璃電極)來測量出溶液的pH值。pH計可以精確到小數點後三位。
計算方法
 ph值的計算公式
ph值的計算公式在pH的計算中,[H+]指的是溶液中氫離子的物質的量濃度(有時也被寫為[H3O+ ],水合氫離子的物質的量濃度),單位為mol/L(摩爾/升),在稀溶液中,氫離子活度約等於氫離子的濃度,可以用氫離子濃度來進行近似計算。
溶液pH值
溶液酸性、中性或鹼性的判斷依據是:[H+ ]和[OH- ]的濃度的相對大小.在任意溫度時溶液[H+ ]>[OH- ]時呈酸性,[H+ ]=[OH- ]時呈中性,[H+ ]<[OH- ]時呈鹼性.但當溶液中[H+ ]、[OH- ]較小時,直接用[H+ ]、[OH- ]的大小關係表示溶液酸鹼性強弱就顯得很不方便。
為了免於用氫離子濃度負冥指數進行計算的繁瑣,丹麥生物化學家澤倫森(Soernsen)在1909年建議將此不便使用的數值用對數代替,並定義為"pH值"。數學上定義pH值為氫離子濃度的常用對數負值,即:pH=-lg[H+ ].在標準溫度(25℃)和壓力下,pH=7的水溶液(如:純水)為中性,這是因為水在標準溫度和壓力下自然電離出的氫離子和氫氧根離子濃度的乘積(水的離子積常數)始終是1×10^(-14),且兩種離子的濃度都是1×10^(-7)mol/L。pH值小說明H+ 的濃度大於OH- 的濃度,故溶液酸性強,而pH值增大則說明H+ 的濃度小於OH- 的濃度,故溶液鹼性強。所以pH值愈小,溶液的酸性愈強;pH愈大,溶液的鹼性也就愈強。
通常pH值是一個介於0和14之間的數,當pH7的時候,溶液呈鹼性,當pH=7的時候,溶液呈中性.但在非水溶液或非標準溫度和壓力的條件下,pH=7可能並不代表溶液呈中性,這需要通過計算該溶劑在這種條件下的電離常數來決定pH為中性的值。如373K(100℃)的溫度下,pH=6為中性溶液。
套用範圍
由pH值的定義可知,pH值是衡量溶液酸鹼性的尺度,在很多方面需要控制溶液的酸鹼,這些地方都需要知道溶液的pH值:
醫學上:人體血液的pH值通常在7.35-7.45之間,如果發生波動,一般可以判斷是病理現象。唾液的pH值也被用於判斷病情。如夏季蚊蟲叮咬會分泌出甲酸(蟻酸),人感到癢,是因為此時pH低於7顯酸性可採用肥皂水、牙膏來增加pH值可以使人減輕痛癢感。
化學和化工上:很多化學反應需要在特定的pH值下進行,否則得不到所期望的產物。
農業上:很多植物有喜酸性土壤或鹼性土壤的習性,如茶的種植。控制土壤的pH值可以使種植的植物生長得更好。
pOH
pOH(氫氧根離子濃度指數)是和pH相對應的表示溶液中氫氧根離子活度的概念。它指的是溶液的鹼度,以溶液中OH-(氫氧根離子)濃度來表示,與pH所表示的溶液酸度相對應,pOH等於氫氧根離子的濃度的負常用對數,即:pOH=-lg[OH- ]。
根據POH值可以計算出溶液中氫氧根離子的濃度。25攝氏度的水溶液中,pOH與pH值關係為pH+pOH=14.0。所以,pH=14.0-pOH。在計算鹼性溶液的pH時必須先計算出溶液的pOH,再根據pH=14.0-pOH計算出溶液的pH值。
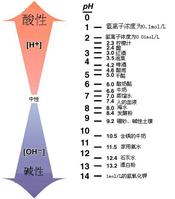
常見的pH值
水的pH值 一些常見物質的pH值
一些常見物質的pH值pH值是水溶液最重要的理化參數之一。凡涉及水溶液的自然現象、化學變化以及生產過程都與pH值有關,因此,在工業、農業、醫學、環保和科研領域都需要測量pH值。
水的pH值是表示水中氫離子活度的負對數值,表示為:pH=-lgaH+。
pH值有時也稱氫離子指數,由於氫離子活度的數值往往很小,在套用上很不方便,所以就用pH值這一概念來作為水溶液酸性、鹼性的判斷指標。而且,氫離子活度的負對數值能夠表示出酸性、鹼性的變化幅度的數量級的大小,這樣套用起來就十分方便,並由此得到:
(1)中性水溶液,pH=-lgaH+=-lg10-7=7;
(2)酸性水溶液,Ph<7,pH值越小,表示酸性越強;
(3)鹼性水溶液,Ph>7,pH值越大,表示鹼性越強。
醫學研究表明,人類的內環境的酸鹼度應該是在7.35到7.45之間,而PH值是以7為酸鹼分界線,也就是說,體液應該呈現弱鹼性才能保持正常的生理功能和物質代謝。人體的體液偏酸的話,細胞的作用就會變弱,它的新陳代謝就會減慢,這時候對一些的臟器功能來說就會造成一定的影響。研究數據表明:當人的體液PH低於中性7時就會產生重大疾病;下降到6.9時就會變成植物人;如果只有6.8到6.7時人就會死亡。
人體血液的正常PH範圍在7.35-7.45,唾液的正常PH範圍為6.8-7.5,尿液的正常PH範圍為6.5-7.8,組織液PH值7.0-7.5,細胞液的PH值7.20-7.45,精液PH值7.8-9.2,宮頸PH值7.5-8.8。體液酸鹼水平同每日的測量時間也有關係。
相關研究
中科院南京土壤研究所深入研究了青藏高原鹼性湖底沉積物細菌群落的空間分布及其驅動機制。2012年在《環境微生物學》雜誌上發表文章表示,研究首次證明了pH是驅動鹼性湖泊沉積物細菌生物地理分布的關鍵因子。
超標事件
2011年12月6日,北京、天津、上海、重慶、香港、澳門等21個城市消協聯合發布運動服比較試驗結果,諾詩蘭、CONVERSE(匡威)、Colunbia、LOTTO(樂途)4個品牌的運動服樣品的ph指標未能達標。PH值是紡織品的安全性指標,標準要求PH值為4.0至9.0,若超標容易引起皮膚瘙癢等炎症。比較試驗中,“諾詩蘭”西弗尼亞女式三穿衝鋒衣、“匡威”連帽拉鏈衫,實測面料PH值均為9.4。
2012年3月31日,台灣地區自在生物科技股份有限公司生產的因特力淨酵素牙膏、兒童酵素牙膏、酵素漱口水,德國的樂固特強化牙膏、抗敏牙膏,均PH值超標。PH值代表牙膏的酸鹼性,過高或過低,都會對牙齒及口腔黏膜產生損傷。
2012年3月,順峰藥業被查出存在環境違法情況,公司外排廢水中pH值、COD均長期超標。
2012年5月22日,多家媒體報導,抽檢顯示廣州1/4睡衣內衣pH值不達標。此次抽查的睡衣內衣檢出的pH值全部偏鹼性,檢測出pH值最高達9.1,pH值是紡織品安全性能中較重要的指標,pH值過高或過低,都會破壞皮膚表面的酸鹼度平衡,從而引起皮膚過敏或誘發感染,使皮膚易受到其他病菌的侵害。
地球一小時相關背景知識
| “地球一小時”活動是由WWF(世界自然基金會)發起的全球最大的環保活動。該活動號召大家在每年3月的最後一個星期六關上燈,並做出一個環保改變,同時動員身邊的其他人也加入環保行列。 |

