理論解釋
 離子積常數
離子積常數R→nMm++mNn-
其中R為溶質,M..和N..分別為電離出來的陽離子和陰離子,其離子積可表示為:
K=[M..]..·[N..]..
與一般的平衡常數表達式相比,離子積常數的表達式少了關於反應物的項。這就限制了離子積常數隻適用於反應物是純液體或純固體的反應,因為在計算平衡常數時,純液體和純固體的濃度視作1。
純液體的離子積
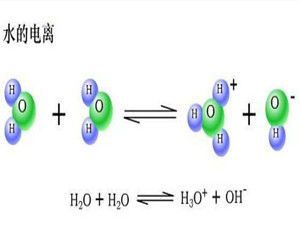
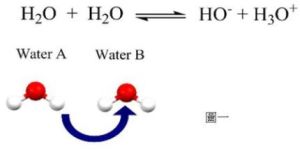
純液體的離子積一般用於溶劑的自耦電離,如水。
水是一種極弱的電解質,它能微弱地電離:
H2O+H2O↔H3O++OH-
通常H3O+簡寫為H+。
水的離子積Kw=[H+]·[OH-],25度時,Kw=1×10^-14。溫度升高時,水的電離程度加大,K..值也隨著上升。
液氨、液態二氧化硫等溶劑也可寫出離子積表達式。
理論特點
難溶電解質的離子積難溶電解質的離子積常數能很好地反映電解質的溶解程度,因此這一種常數又叫做溶度積常數(),符號為K..。
如氯化銀的微弱電離:
AgCl(s)→Ag+(aq)+Cl-(aq),Ksp=1.77ՠ10^-10..
即在25℃的AgCl的飽和溶液中,銀離子濃度與氯離子濃度的乘積為1.77E-10。根據這一點,可以計算出AgCl的溶解度。
在1“分子”溶質電離出離子數相同的情況下,K..越小的,溶解能力也越小。
在不同溫度下,同一物質的K..會有不同的數值。