核酶與酶
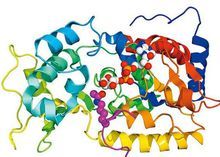 酶
酶為了與酶(enzyme)區分,Cech將它命名為ribozyme,其中文譯名“核酶”已得到大多數人的認可,在非編碼RNA的分類中它也被稱為“催化性小RNA”。
核酶與酶都是極其重要的生物催化劑。核酶是具有催化功能的小分子RNA,酶是具有催化功能的蛋白質。
核酶(催化性小RNA)的發現為“生物催化劑”這個“家庭”增添了一員,從此酶多了一個“弟弟”。因為其本質是RNA,而且不參與翻譯,所以它又屬於組成型非編碼RNA中的一份子。關於催化性RNA的研究,以及其它生物催化劑的探索仍在繼續。
研究歷史
 斯帕蘭扎尼
斯帕蘭扎尼1833年,法國的培安和培洛里將磨碎麥芽的液體作用於澱粉,結果發現澱粉被分解,於是將這個分解澱粉的物質命名為Diastase,也就是現在所謂的澱粉酶。後來,Diastase在法國成為用來表示所有酶的名稱。
1836年,德國馬普生物研究所科學家施旺(T.Schwann,1810—1882)從胃液中提取出了消化蛋白質的物質,解開消化之謎。
“酶”(enzyme)這個名稱的使用,始於19世紀後半,是1872年由居尼所提出的。
1926年,美國科學家薩姆納(J.B.Sumner,1887—1955)從刀豆種子中提取出脲酶的結晶,並通過化學實驗證實脲酶是一種蛋白質。
20世紀30年代,科學家們相繼提取出多種酶的蛋白質結晶,並指出酶是一類具有生物催化作用的蛋白質。
1982年,美國科學家切赫(T.R.Cech,1947—)和奧爾特曼(S.Altman,1939—)發現少數RNA也具有生物催化作用,並將其命名為ribozyme。
1986年,Schultz和Lerner研製成功抗體酶(abzyme)。
分布環境
人體和哺乳動物體內含有5000種酶。它們或是溶解於細胞質中,或是與各種膜結構結合在一起,或是位於細胞內其他結構的特定位置上(是細胞的一種產物),只有在被需要時才被激活,這些酶統稱胞內酶;另外,還有一些在細胞內合成後再分泌至細胞外的酶──胞外酶。酶催化化學反應的能力叫酶活力(或稱酶活性)。酶活力可受多種因素的調節控制,從而使生物體能適應外界條件的變化,維持生命活動。沒有酶的參與,新陳代謝幾乎不能完成,生命活動就根本無法維持。
一般來說,動物體內的酶最適溫度在35到40℃之間,植物體內的酶最適溫度在40-50℃之間;細菌和真菌體內的酶最適溫度差別較大,有的酶最適溫度可高達70℃。動物體內的酶最適PH大多在6.5-8.0之間,但也有例外,如胃蛋白酶的最適PH為1.8,植物體內的酶最適PH大多在4.5-6.5之間。
形態結構
所有的酶都含有C、H、O、N四種元素。按照酶的化學組成可將酶分為單純酶和結合酶兩類。
單純酶分子中只有胺基酸殘基組成的肽鏈。
結合酶分子中則除了多肽鏈組成的蛋白質,還有非蛋白成分,如金屬離子、鐵卟啉或含B族維生素的小分子有機物。結合酶的蛋白質部分稱為酶蛋白(apoenzyme),非蛋白質部分統稱為輔助因子(cofactor),兩者一起組成全酶(holoenzyme);只有全酶才有催化活性,如果兩者分開則酶活力消失。非蛋白質部分如鐵卟啉或含B族維生素的化合物若與酶蛋白以共價鍵相連的稱為輔基(prostheticgroup),用透析或超濾等方法不能使它們與酶蛋白分開;反之兩者以非共價鍵相連的稱為輔酶(coenzyme),可用上述方法把兩者分開。輔助因子有兩大類,一類是金屬離子,且常為輔基,起傳遞電子的作用;另一類是小分子有機化合物,主要起傳遞氫原子、電子或某些化學基團的作用。
結合酶中的金屬離子有多方面功能,它們可能是酶活性中心的組成成分;有的可能在穩定酶分子的構象上起作用;有的可能作為橋樑使酶與底物相連線。輔酶與輔基在催化反應中作為氫(H+和e)或某些化學基團的載體,起傳遞氫或化學基團的作用。體內酶的種類很多,但酶的輔助因子種類並不多,常見到幾種酶均用某種相同的金屬離子作為輔助因子的例子,同樣的情況亦見於輔酶與輔基,如3-磷酸甘油醛脫氫酶和乳酸脫氫酶均以NAD+作為輔酶。酶催化反應的特異性決定於酶蛋白部分,而輔酶與輔基的作用是參與具體的反應過程中氫(H+和e)及一些特殊化學基團的運載。
酶屬生物大分子,分子質量至少在1萬以上,大的可達百萬。酶的催化作用有賴於酶分子的一級結構及空間結構的完整。若酶分子變性或亞基解聚均可導致酶活性喪失。一個值得注意的問題是酶所催化的反應物即底物(substrate),卻大多為小分物質它們的分子質量比酶要小几個數量級。
酶的活性中心(activecenter)只是酶分子中的很小部分,酶蛋白的大部分胺基酸殘基並不與底物接觸。組成酶活性中心的胺基酸殘基的側鏈存在不同的功能基團,如-NH2。-COOH、-SH、-OH和咪唑基等,它們來自酶分子多肽鏈的不同部位。有的基團在與底物結合時起結合基團(bindinggroup)的作用,有的在催化反應中起催化基團(catalyticgroup)的作用。但有的基團既在結合中起作用,又在催化中起作用,所以常將活性部位的功能基團統稱為必需基團(essentialgroup)。它們通過多肽鏈的盤曲摺疊,組成一個在酶分子表面、具有三維空間結構的孔穴或裂隙,以容納進入的底物與之結合併催化底物轉變為產物,這個區域即稱為酶的活性中心。
而酶活性中心以外的功能集團則在形成並維持酶的空間構象上也是必需的,故稱為活性中心以外的必需基團。對需要輔助因子的酶來說,輔助因子也是活性中心的組成部分。酶催化反應的特異性實際上決定於酶活性中心的結合基團、催化基團及其空間結構。
命名方法
通常有習慣命名和系統命名兩種方法。
習慣命名
常根據兩個原則:
1.酶的作用底物,如澱粉酶;
2催化反應的類型,如脫氫酶。
也有根據上述兩項原則綜合命名或加上酶的其它特點,如琥珀酸脫氫酶、鹼性磷酸酶等等。
習慣命名較簡單,習用較久,但缺乏系統性又不甚合理,以致造成某些酶的名稱混亂。如:腸激酶和肌激酶,從字面看,很似來源不同而作用相似的兩種酶,實際上它們的作用方式截然不同。又比如:銅硫解酶和乙醯輔酶A轉醯基酶實際上是同一種酶,但名稱卻完全不同。
鑒於上述情況和新發現的酶不斷增加,為適應酶學發展的新情況,國際生化協會酶委員會推薦了一套系統的酶命名方案和分類方法,決定每一種酶應有系統名稱和習慣名稱。同時每一種酶有一個固定編號。
系統命名
酶的系統命名是以酶所催化的整體反應為基礎的。
例如一種編號為“3.4.21.4”的胰蛋白酶,
第一個數字“3”表示水解酶;
第二個數字“4”表示它是蛋白酶水解肽鍵;
第三個數字“21”表示它是絲氨酸蛋白酶,活性位上有一重要的絲氨酸殘基;
第四個數字“4”表示它是這一類型中被指認的第四個酶。
規定,每種酶的名稱應明確寫出底物名稱及其催化性質。若酶反應中有兩種底物起反應,則這兩種底物均需列出,當中用“:”分隔開。
例如:谷丙轉氨酶(習慣名稱)寫成系統名時,應將它的兩個底物“L-丙氨酸”“α-酮戊二酸”同時列出,它所催化的反應性質為轉氨基,也需指明,故其名稱為“L-丙氨酸:α-酮戊二酸轉氨酶”。
由於系統命名一般都很長,使用時不方便,因此敘述時可採用習慣名。
酶類(酵素)類產品是糖和水果進行發酵之後的產物,也就是“水果泡菜”加上“低度甜味水果酒”的混合物。(比如一種青梅全發酵(非浸泡的)的低度果酒)
分類方式
按反應性質
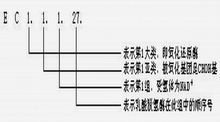 乳酸脫氫酶催化反應
乳酸脫氫酶催化反應氧化還原酶類(oxidoreductase)促進底物進行氧化還原反應的酶類,是一類催化氧化還原反應的酶,可分為氧化酶和還原酶兩類。
轉移酶類(transferases)催化底物之間進行某些基團(如乙醯基、甲基、氨基、磷酸基等)的轉移或交換的酶類。例如,甲基轉移酶、氨基轉移酶、乙醯轉移酶、轉硫酶、激酶和多聚酶等。
水解酶類(hydrolases)催化底物發生水解反應的酶類。例如,澱粉酶、蛋白酶、脂肪酶、磷酸酶、糖苷酶等。
裂合酶類(lyases)催化從底物(非水解)移去一個基團並留下雙鍵的反應或其逆反應的酶類。例如,脫水酶、脫羧酶、碳酸酐酶、醛縮酶、檸檬酸合酶等。許多裂合酶催化逆反應,使兩底物間形成新化學鍵並消除一個底物的雙鍵。合酶便屬於此類。
異構酶類(isomerases)催化各種同分異構體、幾何異構體或光學異構體之間相互轉化的酶類。例如,異構酶、表構酶、消鏇酶等。
合成酶類(ligase)催化兩分子底物合成為一分子化合物,同時偶聯有ATP的磷酸鍵斷裂釋能的酶類。例如,谷氨醯胺合成酶、DNA連線酶、胺基酸:tRNA連線酶以及依賴生物素的羧化酶等。
按照國際生化協會公布的酶的統一分類原則,在上述六大類基礎上,在每一大類酶中又根據底物中被作用的基團或鍵的特點,分為若干亞類;為了更精確地表明底物或反應物的性質,每一個亞類再分為幾個組(亞亞類);每個組中直接包含若干個酶。
例如:乳酸脫氫酶(EC1.1.1.27)催化下列反應:
按酶的化學組成
單純蛋白質
屬於單純蛋白質的酶類,除了蛋白質外,不含其他物質,如脲酶、蛋白酶、澱粉酶、脂肪酶和核糖核酸酶等
綴合蛋白質
屬於綴合蛋白質的酶類,除了蛋白質外,還要結合一些對熱穩定的非蛋白質小分子物質或金屬離子,前者稱為脫輔酶,後者稱為輔因子,脫輔酶與輔因子結合後所形成的複合物稱為全酶,即全酶=脫輔酶+輔因子。
按存在形式
前體酶原
有些酶如消化系統中的各種蛋白酶以無活性的前體形式合成和分泌,然後,輸送到特定的部位,當體內需要時,經特異性蛋白水解酶的作用轉變為有活性的酶而發揮作用。這些不具催化活性的酶的前體稱為酶原(zymogen)。如胃蛋白酶原(pepsinogen)、胰蛋白酶原(trypsinogen)和胰凝乳蛋白酶原(chymotrypsinogen)等。某種物質作用於酶原使之轉變成有活性的酶的過程稱為酶原的激活(zymogenandactivationofzymogen)。使無活性的酶原轉變為有活性的酶的物質稱為活化素。活化素對於酶原的激活作用具有一定的特異性。
例如胰腺細胞合成的糜蛋白酶原為245個胺基酸殘基組成的單一肽鏈,分子內部有5對二硫鍵相連,該酶原的激活過程如圖4-3所示。首先由胰蛋白酶水解15位精氨酸和16位異亮氨酸殘基間的肽鍵,激活成有完全催化活性的p-糜蛋白酶,但此時酶分子尚未穩定,經p-糜蛋白酶自身催化,去除二分子二肽成為有催化活性井具穩定結構的α—糜蛋白酶。
在正常情況下,血漿中大多數凝血因子基本上是以無活性的酶原形式存在,只有當組織或血管內膜受損後,無活性的酶原才能轉變為有活性的酶,從而觸發一系列的級聯式酶促反應,最終導致可溶性的纖維蛋白原轉變為穩定的纖維蛋白多聚體,網羅血小板等形成血凝塊。
酶原激活的本質是切斷酶原分子中特異肽鍵或去除部分肽段後有利於酶活性中心的形成酶原激活有重要的生理意義,一方面它保證合成酶的細胞本身不受蛋白酶的消化破壞,另一方面使它們在特定的生理條件和規定的部位受到激活並發揮其生理作用。如組織或血管內膜受損後激活凝血因子;胃主細胞分泌的胃蛋白酶原和胰腺細胞分泌的糜蛋白酶原、胰蛋白酶原、彈性蛋白酶原等分別在胃和小腸激活成相應的活性酶,促進食物蛋白質的消化就是明顯的例證。特定肽鍵的斷裂所導致的酶原激活在生物體內廣泛存在,是生物體的一種重要的調控酶活性的方式。如果酶原的激活過程發生異常,將導致一系列疾病的發生。出血性胰腺炎的發生就是由於蛋白酶原在未進小腸時就被激活,激活的蛋白酶水解自身的胰腺細胞,導致胰腺出血、腫脹。
同工酶
同工酶(isoenzyme)的概念:即同工酶是一類催化相同的化學反應,但酶蛋白的分子結構、理化性質和免疫原性各不相同的一類酶。它們存在於生物的同一種族或同一個體的不同組織,甚至在同一組織、同一細胞的不同細胞器中。至今已知的同工酶已不下幾十種,如己糖激酶,乳酸脫氫酶等,其中以乳酸脫氫酶(Lacticaciddehydrogenase,LDH)研究得最為清楚。人和脊柱動物組織中,有五種分子形式,它們催化下列相同的化學反應:
五種同工酶均由四個亞基組成。LDH的亞基有骨骼肌型(M型)和心肌型(H型)之分,兩型亞基的胺基酸組成不同,由兩種亞基以不同比例組成的四聚體,存在五種LDH形式。即H4(LDHl)、H3M1(LDH2)、H2M2(LDH3)、H1M3(LDH4)和M4(LDH5)。
M、H亞基的胺基酸組成不同,這是由基因不同所決定。五種LDH中的M、H亞基比例各異,決定了它們理化性質的差別。通常用電冰法可把五種LDH分開,LDH1向正極泳動速度最快,而LDH5泳動最慢,其它幾種介於兩者之間,依次為LDH2。LDH3和LDH4。不同組織中各種LDH所含的量不同,心肌中以LDHl及LDH2的量較多,而骨骼肌及肝中LDH5和LDH4為主。不同組織中LDH同工酶譜的差異與組織利用乳酸的生理過程有關。LDH1和LDH2對乳酸的親和力大,使乳酸脫氫氧化成丙酮酸,有利於心肌從乳酸氧化中取得能量。LDH5和LDH4對丙酮酸的親和力大,有使丙酮酸還原為乳酸的作用,這與肌肉在無氧酵解中取得能量的生理過程相適應(詳見糖代謝章)。在組織病變時這些同工酶釋放入血,由於同工酶在組織器官中分布差異,因此血清同工酶譜就有了變化。故臨床常用血清同工酶譜分析來診斷疾病。
別構酶
別構酶(allostericenzyme)往往是具有四級結構的多亞基的寡聚酶,酶分子中除有催化作用的活性中心也稱催化位點(catalyticsite)外;還有別構位點(allostericsite)。後者是結合別構劑(allestericeffector)的位置,當它與別構劑結合時,酶的分子構象就會發生輕微變化,影響到催化位點對底物的親和力和催化效率。若別構劑結合使酶與底物親和力或催化效率增高的稱為別構激活劑(allostericactivator),反之使酶底物的r親和力或催化效率降低的稱為別構抑制劑(allostericinhibitor)。酶活性受別構劑調節的作用稱為別構調節(allostericregulation)作用。別構酶的催化位點與別構位點可共處一個亞基的不同部位,但更多的是分別處於不同亞基上。在後一種情況下具催化位點的亞基稱催化亞基,而具別構位點的稱調節亞基。多數別構酶處於代謝途徑的開端,而別構酶的別構劑往往是一些生理性小分子及該酶作用的底物或該代謝途徑的中間產物或終產物。故別構酶的催化活性受細胞內底物濃度、代謝中間物或終產物濃度的調節。終產物抑制該途徑中的別構酶稱反饋抑制(feedbackinhibition)。說明一旦細胞內終產物增多,它作為別構抑制劑抑制處於代謝途徑起始的酶,及時調整該代謝途徑的速度,以適應細胞生理機能的需要。別構酶在細胞物質代謝上的調節中發揮重要作用。故別構酶又稱調節酶。(regulatoryenzyme)
修飾酶
體內有些酶需在其它酶作用下,對酶分子結構進行修飾後才具催化活性,這類酶稱為修飾酶(modificationenzyme)。其中以共價修飾為多見,如酶蛋白的絲氨酸,蘇氨酸殘基的功能基團-OH可被磷酸化,這時伴有共價鍵的修飾變化生成,故稱共價修飾(covalentmodification)。由於這種修飾導致酶活力改變稱為酶的共價修飾調節(covalentmodificationregulation)。體內最常見的共價修飾是酶的磷酸化與去磷酸化,此外還有酶的乙醯化與去乙醯化、尿苷酸化與去尿苷酸化、甲基化與去甲基化。由於共價修飾反應迅速,具有級聯式放大效應所以亦是體內調節物質代謝的重要方式。如催化糖原分解第一步反應的糖原磷酸化酶存在有活性和無活性兩種形式,有活性的稱為磷酸化酶a,無活性的稱為磷酸化酶b,這兩種形式的互變就是通過酶分子的磷酸化與去磷酸化的過程(詳見糖代謝章)
多酶複合體與多酶體系
體內有些酶彼此聚合在一起,組成一個物理的結合體,此結合體稱為多酶複合體(multienzymecomplex)。若把多酶複合體解體,則各酶的催化活性消失。參與組成多酶複合體的酶有多有少,如催化丙酮酸氧化脫羧反應的丙酮酸脫氫酶多酶複合體由三種酶組成,而線上粒體中催化脂肪酸β-氧化的多酶複合體由四種酶組成。多酶複合體第一個酶催化反應的產物成為第二個酶作用的底物,如此連續進行,直至終產物生成。
多酶複合體由於有物理結合,在空間構象上有利於這種流水作業的快速進行,是生物體提高酶催化效率的一種有效措施。
體內物質代謝的各條途逕往往有許多酶共同參與,依次完成反應過程,這些酶不同於多酶複合體,在結構上無彼此關聯。故稱為多酶體系(multienzymesystem)。如參與糖酵解的11個酶均存在於胞液,組成一個多酶體系。
多功能酶
21世紀發現有些酶分子存在多種催化活性,例如大腸桿菌DNA聚合酶I是一條分子質量為109kDa的多肽鏈,具有催化DNA鏈的合成、3’-5’核酸外切酶和5’-3’核酸外切酶的活性,用蛋白水解酶輕度水解得兩個肽段,一個含5’-3’核酸外切酶活性,另一個含另兩種酶的活性,表明大腸桿菌DNA聚合酶分子中含多個活性中心。哺乳動物的脂肪酸合成酶由兩條多肽鏈組成,每一條多肽鏈均含脂肪酸合成所需的七種酶的催化活性。這種酶分子中存在多種催化活性部位的酶稱為多功能酶(multifunctionalenzyme)或串聯酶(tandemenzyme)。多功能酶在分子結構上比多酶複合體更具有優越性,因為相關的化學反應在一個酶分子上進行,比多酶複合體更有效,這也是生物進化的結果。
活力情況
酶活力單位(U,activeunit):
 拓撲異構酶
拓撲異構酶1972年,IUBMB下屬的酶學委員會推薦一個新的單位“催量”Kat來表示酶活力單位,1Kat定義為:
最適條件下,每秒內催化1mol/L底物轉化為產物所需的酶量定為1Kat。
比活(specificactivity):每分鐘每毫克酶蛋白在25℃下轉化的底物的微摩爾數。比活是酶純度的測量。
活化能(activationenergy):將1mol反應底物中所有分子由基態轉化為過渡態所需要的能量。
活性部位(activesite):酶中含有底物結合部位和參與催化底物轉化為產物的胺基酸殘基部分。活性部位通常位於蛋白質的結構域或亞基之間的裂隙或是蛋白質表面的凹陷部位,通常都是由在三維空間上靠得很緊的一些胺基酸殘基組成。
活性測定
初速度(initialvelocity):酶促反應最初階段底物轉化為產物的速度,這一階段產物的濃度非常低,其逆反應可以忽略不計。
米氏方程(Michaelis-Mententequation):表示一個酶促反應的起始速度(υ)與底物濃度([s])關係的速度方程:υ=υmax[s]/(Km+[s])
米氏常數(Michaelisconstant):對於一個給定的反應,使酶促反應的起始速度(υ0)達到最大反應速度(υmax)一半時的底物濃度。
催化常數(catalyticnumber)(Kcat):也稱為轉換數。是一個動力學常數,是在底物處於飽和狀態下一個酶(或一個酶活性部位)催化一個反應有多快的測量。
催化常數等於最大反應速度除以總的酶濃度(υmax/[E]total)。或是每摩酶活性部位每秒鐘轉化為產物的底物的量(摩[爾])。
雙倒數作圖(double-reciprocalplot):那稱為Lineweaver_Burk作圖。一個酶促反應的速度的倒數(1/V)對底物度的倒數(1/LSF)的作圖。x和y軸上的截距分別代表米氏常數和最大反應速度的倒數。
活性調節
競爭性抑制作用(competitiveinhibition):通過增加底物濃度可以逆轉的一種酶抑制類型。競爭性抑制劑通常與正常的底物或配體競爭同一個蛋白質的結合部位。這種抑制使Km增大而υmax不變。
非競爭性抑制作用(noncompetitiveinhibition):抑制劑不僅與游離酶結合,也可以與酶-底物複合物結合的一種酶促反應抑制作用。這種抑制使Km不變而υmax變小。
反競爭性抑制作用(uncompetitiveinhibition):抑制劑只與酶-底物複合物結合而不與游離的酶結合的一種酶促反應抑制作用。這種抑制使Km和υmax都變小但υmax/Km不變。
很大一類複雜的蛋白質物質[enzyme;ferment],在促進可逆反應(如水解和氧化)方面起著像催化劑一樣的作用。在許多工業過程中是有用的(如發酵、皮革鞣製及乾酪生產)
酶是一種有機的膠狀物質,由蛋白質組成,對於生物的化學變化起催化作用,發酵就是靠它的作用:~原。
影響活力因素
米契里斯(Michaelis)和門坦(Menten)根據中間產物學說推導出酶促反應速度方程式,即米-門公式(具體參考《環境工程微生物學》第四章微生物的生理)。由米門公式可知:酶促反應速度受酶濃度和底物濃度的影響,也受溫度、pH、激活劑和抑制劑的影響。
(1)酶濃度對酶促反應速度的影響
從米門公式和酶濃度與酶促反應速度的關係圖解可以看出:酶促反應速度與酶分子的濃度成正比。當底物分子濃度足夠時,酶分子越多,底物轉化的速度越快。但事實上,當酶濃度很高時,並不保持這種關係,曲線逐漸趨向平緩。根據分析,這可能是高濃度的底物夾帶有許多的抑制劑所致。
(2)底物濃度對酶促反應速度的影響
在生化反應中,若酶的濃度為定值,底物的起始濃度較低時,酶促反應速度與底物濃度成正比,即隨底物濃度的增加而增加。當所有的酶與底物結合生成中間產物後,即使在增加底物濃度,中間產物濃度也不會增加,酶促反應速度也不增加。
還可以得出,在底物濃度相同條件下,酶促反應速度與酶的初始濃度成正比。酶的初始濃度大,其酶促反應速度就大。
在實際測定中,即使酶濃度足夠高,隨底物濃度的升高,酶促反應速度並沒有因此增加,甚至受到抑制。其原因是:高濃度底物降低了水的有效濃度,降低了分子擴散性,從而降低了酶促反應速度。過量的底物聚集在酶分子上,生成無活性的中間產物,不能釋放出酶分子,從而也會降低反應速度。
(3)溫度對酶促反應速度的影響
各種酶在最適溫度範圍內,酶活性最強,酶促反應速度最大。在適宜的溫度範圍內,溫度每升高10℃,酶促反應速度可以相應提高1~2倍。不同生物體內酶的最適溫度不同。如,動物組織中各種酶的最適溫度為37~40℃;微生物體內各種酶的最適溫度為25~60℃,但也有例外,如黑曲糖化酶的最適溫度為62~64℃;巨大芽孢桿菌、短乳酸桿菌、產氣桿菌等體內的葡萄糖異構酶的最適溫度為80℃;枯草桿菌的液化型澱粉酶的最適溫度為85~94℃。可見,一些芽孢桿菌的酶的熱穩定性較高。過高或過低的溫度都會降低酶的催化效率,即降低酶促反應速度。
最適溫度在60℃以下的酶,當溫度達到60~80℃時,大部分酶被破壞,發生不可逆變性;當溫度接近100℃時,酶的催化作用完全喪失。
所以,人在發燒時,不想吃東西。
(4)pH對酶促反應速度的影響
酶在最適pH範圍內表現出活性,大於或小於最適pH,都會降低酶活性。主要表現在兩個方面:①改變底物分子和酶分子的帶電狀態,從而影響酶和底物的結合;②過高或過低的pH都會影響酶的穩定性,進而使酶遭受不可逆破壞。人體中的大部分酶所處環境的pH值越接近7,催化效果越好。但人體中的胃蛋白酶卻適宜在pH值為1~2的環境中,胰蛋白酶的最適pH在8左右。
(5)激活劑對酶促反應速度的影響
能激活酶的物質稱為酶的激活劑。
激活劑種類:
①無機陽離子,如鈉離子、鉀離子、銅離子、鈣離子等;
②無機陰離子,如氯離子、溴離子、碘離子、硫酸鹽離子磷酸鹽離子等;
③有機化合物,如維生素C、半胱氨酸、還原性谷胱甘肽等。許多酶只有當某一種適當的激活劑存在時,才表現出催化活性或強化其催化活性,這稱為對酶的激活作用。而有些酶被合成後呈現無活性狀態,這種酶稱為酶原。它必須經過適當的激活劑激活後才具活性。
(6)抑制劑對酶促反應速度的影響
能減弱、抑制甚至破壞酶活性的物質稱為酶的抑制劑。它可降低酶促反應速度。酶的抑制劑有重金屬離子、一氧化碳、硫化氫、氫氰酸、氟化物、碘化乙酸、生物鹼、染料、對-氯汞苯甲酸、二異丙基氟磷酸、乙二胺四乙酸、表面活性劑等。
對酶促反應的抑制可分為競爭性抑制和非競爭性抑制。與底物結構類似的物質爭先與酶的活性中心結合,從而降低酶促反應速度,這種作用稱為競爭性抑制。競爭性抑制是可逆性抑制,通過增加底物濃度最終可解除抑制,恢復酶的活性。與底物結構類似的物質稱為競爭性抑制劑。抑制劑與酶活性中心以外的位點結合後,底物仍可與酶活性中心結合,但酶不顯示活性,這種作用稱為非競爭性抑制。非競爭性抑制是不可逆的,增加底物濃度並不能解除對酶活性的抑制。與酶活性中心以外的位點結合的抑制劑,稱為非競爭性抑制劑。
有的物質既可作為一種酶的抑制劑,又可作為另一種酶的激活劑。
學科運用
動力學
酶動力學是研究酶結合底物能力和催化反應速率的科學。研究者通過酶反應分析法(enzymeassay)來獲得用於酶動力學分析的反應速率數據。
1902年,維克多·亨得利提出了酶動力學的定量理論;隨後該理論得到他人證實並擴展為米氏方程。亨利最大貢獻在於其首次提出酶催化反應由兩步組成:首先,底物可逆地結合到酶上,形成酶-底物複合物;然後,酶完成對對應化學反應的催化,並釋放生成的產物。
酶初始反應速率(表示為“V”)與底物濃度(表示為“[S]”)的關係曲線。隨著底物濃度不斷提高,酶的反應速率也趨向於最大反應速率(表示為“Vmax”)。酶可以在一秒鐘內催化數百萬個反應。例如,乳清酸核苷5'-磷酸脫羧酶所催化的反應在無酶情況下,需要七千八百萬年才能將一半的底物轉化為產物;而同樣的反應過程,如果加入這種脫羧酶,則需要的時間只有25毫秒。酶催化速率依賴於反應條件和底物濃度。如果反應條件中存在能夠將蛋白解鏈的因素,如高溫、極端的pH和高的鹽濃度,都會破壞酶的活性;而提高反應體系中的底物濃度則會增加酶的活性。在酶濃度固定的情況下,隨著底物濃度的不斷升高,酶催化的反應速率也不斷加快並趨向於最大反應速率(Vmax)。出現這種現象的原因是,當反應體系中底物的濃度升高,越來越多自由狀態下的酶分子結合底物形成酶-底物複合物;當所有酶分子的活性位點都被底物飽和結合,即所有酶分子形成酶-底物複合物時,催化的反應速率達到最大。當然,Vmax並不是酶唯一的動力學常數,要達到一定反應速率所需的底物濃度也是一個重要的動力學指標。這一動力學指標即米氏常數(Km),指的是達到Vmax值一半的反應速率所需的底物濃度。對於特定的底物,每一種酶都有其特徵Km值,表示底物與酶之間的結合強度(Km值越低,結合越牢固,親和力越高)。另一個重要的動力學指標是kcat(催化常數),定義為一個酶活性位點在一秒鐘內催化底物的數量,用於表示酶催化特定底物的能力。
酶的催化效率可以用kcat/Km來衡量。這一表示式又被稱為特異性常數,其包含了催化反應中所有步驟的反應常數。由於特異性常數同時反映了酶對底物的親和力和催化能力,因此可以用於比較不同酶對於特定底物的催化效率或同一種酶對於不同底物的催化效率。特異性常數的理論最大值,又稱為擴散極限,約為108至109M−1s−1;此時,酶與底物的每一次碰撞都會導致底物被催化,因此產物的生成速率不再為反應速率所主導,而分子的擴散速率起到了決定性作用。酶的這種特性被稱為“催化完美性”或“動力學完美性”。相關的酶的例子有磷酸丙糖異構酶、碳酸酐酶、乙醯膽鹼酯酶、過氧化氫酶、延胡索酸酶、β-內醯胺酶和超氧化物歧化酶。
米氏方程是基於質量作用定律而確立的,而該定律則基於自由擴散和熱動力學驅動的碰撞這些假定。然而,由於酶/底物/產物的高濃度和相分離或者一維/二維分子運動,許多生化或細胞進程明顯偏離質量作用定律的假定。在這些情況下,可以套用分形米氏方程。
存在一些酶,它們的催化產物動力學速率甚至高於分子擴散速率,這種現象無法用當今公認的理論來解釋。有多種理論模型被提出來解釋這類現象。其中,部分情況可以用酶對底物的附加效應來解釋,即一些酶被認為可以通過雙偶極電場來捕捉底物以及將底物以正確方位擺放到催化活性位點。另一種理論模型引入了基於量子理論的穿隧效應,即質子或電子可以穿過激活能壘(就如同穿過隧道一般),但關於穿隧效應還有較多爭議。有報導發現色胺中質子存在量子穿隧效應。因此,有研究者相信在酶催化中也存在著穿隧效應,可以直接穿過反應能壘,而不是像傳統理論模型的方式通過降低能壘達到催化效果。有相關的實驗報導提出在一種醇脫氫酶的催化反應中存在穿隧效應,但穿隧效應是否在酶催化反應中普遍存在並未有定論。
熱力學
與其他催化劑一樣,酶並不改變反應的平衡常數,而是通過降低反應的活化能來加快反應速率。通常情況下,反應在酶存在或不存在的兩種條件下,其反應方向是相同的,只是前者的反應速度更快一些。但必須指出的是,在酶不存在的情況下,底物可以通過其他不受催化的“自由”反應生成不同的產物,原因是這些不同產物的形成速度更快。
酶可以連線兩個或多個反應,因此可以用一個熱力學上更容易發生的反應去“驅動”另一個熱力學上不容易發生的反應。例如,細胞常常通過ATP被酶水解所產生的能量來驅動其他化學反應。
酶可以同等地催化正向反應和逆向反應,而並不改變反應自身的化學平衡。例如,碳酸酐酶可以催化如下兩個互逆反應,催化哪一種反應則是依賴於反應物濃度。
當然,如果反應平衡極大地趨向於某一方向,比如釋放高能量的反應,而逆反應不可能有效的發生,則此時酶實際上不催化熱力學上允許的方向,而只催化其逆反應。
![酵素[酶的別稱] 酵素[酶的別稱]](/img/5/92f/n5GcuM3X4ATM0kDNzgDN3EzN0UTM2EjM3ITM1QTNwAzMwIzL4QzL1MzLt92YucmbvRWdo5Cd0FmLyE2LvoDc0RHa.jpg)
