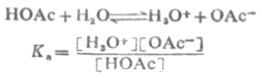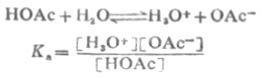 酸鹼理論
酸鹼理論質子理論
1923年丹麥科學家J.N.布侖斯惕和英國科學家T.M.勞里同時提出酸鹼質子理論:酸(A)是具有給出質子傾向的物質,而鹼(B)是具有接受質子傾向的物質,例如:HA↔H+ +A- 其中A- 即為B,這樣相差一個質子的兩種物質(即HA和B)叫共軛酸鹼對。按照這個理論,HCl、H3PO4是分子酸,NH4+ 、Al(H2O)63+ 是陽離子酸,H2PO4- 是陰離子酸;而NH3是分子鹼,Al(OH)(H2O)2+ 則是陽離子鹼,H2PO4- 、Cl- 是陰離子鹼。有些物質(如H2PO4- )在某一共軛酸鹼對(如 H3PO4-H2PO4- )中是鹼,而在另一共軛酸鹼對(H2PO4- -HPO42- )中是酸。酸給出質子的傾向愈強,則其共軛鹼接受質子的傾向愈弱;若鹼接受質子的傾向愈強,則其共軛酸給出質子的傾向愈弱。
質子傳遞反應只能發生在兩個共軛酸鹼對之間:
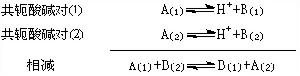
酸鹼質子理論認為,阿倫尼烏斯理論中所謂的弱酸、弱鹼電離平衡,弱酸根、弱鹼根離子水解,中和反應,鹽的生成,水的自電離等都是質子傳遞反應(表1)。
 酸鹼理論
酸鹼理論H2SO4+HNO3─→HSO4- +H2NO3+
質子理論把酸鹼範圍擴大了。質子酸實際上是質子和共軛鹼的加合物,酸鹼反應都可用質子傳遞來討論。路易斯酸鹼理論
1923年美國科學家G.N.路易斯從結構觀點提出廣義的酸鹼電子理論:給出電子對的物質是鹼,接受電子對的物質是酸,酸鹼結合成加合物(表2)。 酸鹼理論
酸鹼理論按照路易斯理論,酸(A)和鹼(B)的反應如下:
① 雙取代反應(表3):表中所列A(1)是較強的酸,B(2)是較強的鹼,A(1):B(2)是較穩定的加合物,即酸鹼反應本質是,強酸和強鹼取代弱酸和弱鹼,生成配位鍵(見共價鍵)較強的加合物,這是配位鍵的調整而不是生成新的配位鍵。
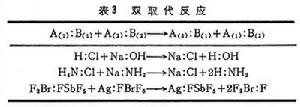 酸鹼理論
酸鹼理論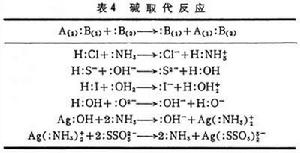 酸鹼理論
酸鹼理論③ 酸取代反應:原先與H+結合的OH-轉為與CO2結合,又轉為與SO3結合。這種反應又稱親電取代反應。
 酸鹼理論
酸鹼理論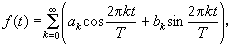
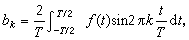
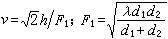
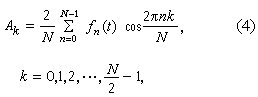
其他酸鹼理論
① 溶劑體系理論與水相似,許多溶劑能自電離,形成特徵的陽離子和陰離子:
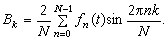
Cs2SO3+SOCl2─→2SO2+2CsCl
Cs2SO3和SOCl2滴定,就像在水溶液中酸鹼滴定生成水一樣。溶劑體系適用於能解離的溶劑。② 烏沙諾維奇理論
又稱正負理論。1939年蘇聯科學家М.И.烏沙諾維奇提出:凡能與鹼反應,給出陽離子,接受陰離子或電子的物質是酸;凡能與酸反應,與陽離子結合,給出陰離子或電子的物質是鹼。這個理論幾乎包括所有路易斯理論的酸鹼反應,如:
Na2O+SO3─→2Na++SO娸
2Na+Cl2─→2Na++2Cl-
前一反應中的酸是SO3,因它得到O2-生成SO娸;後一反應中Na把電子給予Cl,所以Na是鹼。即氧化劑是酸,還原劑是鹼。烏氏酸鹼理論包括了氧化還原反應,適用範圍更廣。③ 勒克斯-弗勒德理論
1939年 H.勒克斯提出的,1947年經H.弗勒德發展的以“O2-”離子來定義酸鹼的理論。氧離子給予體是鹼,氧離子接受體是酸,如:
CaO+SO3─→CaSO4
式中CaO是鹼;SO3是酸。這種理論適用於含氧而不含質子的反應體系,主要用於熔融的氧化物體系。酸鹼食物合理搭配
 酸鹼食物合理搭配
酸鹼食物合理搭配 而所謂食物的酸鹼性,是說食物中的無機鹽屬於酸性還是屬於鹼性。
一般金屬元素鈉、鈣、鎂等,在人體內其氧化物呈鹼性,含這種元素較多的食物就是鹼性食物,如大豆、豆腐、菠菜、萵筍、蘿蔔、土豆、藕、洋蔥、海帶、西瓜、香蕉、梨、蘋果、牛奶等。
一些食物中含有較多的非金屬元素,如磷、硫、氯等,在人體內氧化後,生成帶有陰離子的酸根,屬於酸性食物。如豬肉、牛肉、雞肉、鴨、蛋類、鯉魚、牡蠣、蝦,以及麵粉、大米、花生、大麥、啤酒等。
因此,家常菜一定要注意酸、鹼食物的合理搭配,否則,進食酸性食物過多,可造成血液偏酸性。為中和這些酸性物質,又必然消耗體內大量的鈣、鎂等鹼性元素,而引起缺鈣等一系列症狀,如皮膚病、神經病,特別是在節假日裡,如果肉類較多,就更應該注意搭配一些新鮮蔬菜、水果等鹼性食物,以免造成機體酸鹼平衡失調。
相關條目
無機化學
| 無機化學是除碳氫化合物及其衍生物外,對所有元素及其化合物的性質和他們的反應進行實驗研究和理論解釋的科學,是化學學科中發展最早的一個分支學科。現在讓我們來認識一下這部分化學知識吧。 |