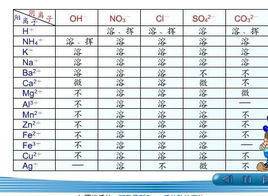
概述
 酸鹼質子理論
酸鹼質子理論當一個分子或離子釋放氫離子,同時一定有另一個分子或離子接受氫離子,因此酸和鹼會成對出現。酸鹼質子理論可以用以下反應式說明:
酸+鹼≒共軛鹼+共軛酸
酸在失去一個氫離子後,變成共軛鹼;而鹼得到一個氫離子後,變成共軛酸。以上反應可能以正反應或逆反應的方式來進行,不過不論是正反應或逆反應,均維持以下的原則:酸將一個氫離子轉移給鹼。
在上式中,酸和其對應的共軛鹼為一組共軛酸鹼對。而鹼和其對應的共軛酸也是一組共軛酸鹼對。在這裡,酸和鹼具有同一性,互為存在條件,在一定條件下又朝著與自己相反的方向轉化,這是符合唯物辯證法的。
概念
酸鹼離子理論是阿累尼烏其斯(Arrhenius)根據他的電離學說提出來的。他認為在水中能電離出氫離子並且不產生其它陽離子的物質叫酸。在水中能電離出氫氧根離子並且不產生其它陰離子的物質叫鹼。酸鹼中和反應的實質是氫離子和氫氧根離子結合成水。這個理論取得了很大成功,但它的局限性也早就暴露出來,倒台。例如氣態氨與氯化氫反應迅速生成氯化銨,這個酸鹼中和反應並未摻雜水的生成;又如氨的水溶液顯鹼性,曾被錯誤地認為是NH3和H2O形成弱電解質NH4OH分子,然後離解出OH-等。
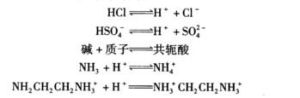
由於阿累尼烏斯的酸鹼離子理論不能解一些非水溶液中進行的酸鹼反應等問題,1923年布朗斯特(Bronsted)提出了酸鹼質子理論,把酸鹼概念加以推廣。酸鹼質子理論認為凡是能給出質子的物質都是酸,凡是能與質子結合的物質都是鹼。即酸是質子的給予體,鹼是質子的接受體。這樣,一個酸給出質子後餘下的部分自然就是鹼,因為它本身就是與質子結合的。它們的關係如下:
這種關係叫做酸鹼的共軛關係,式中略去了HB和B可能出現的電荷。右邊的鹼是左邊酸的共軛鹼,左邊的酸是右邊鹼的共軛酸,兩者組成一個共軛酸鹼對,它們只差一個質子。
酸和鹼可以是分子,也可以是陽離子和陰離子。還可以看出,像(HPO4)2-這樣的物質,既表現酸,也表現為鹼,所以它是兩性物質。同理,H2O,HCO3-等也是兩性物質。
共軛酸鹼
 酸鹼質子理論
酸鹼質子理論用KW表示[H3O+][OH-],KW稱為水的離子積。這說明在一定溫度下,水中的[H3O+]與[OH-]的乘積為一常數。所以 Ka·Kb=KW
24℃時KW值為1.0×10-14.這個關係說明,只知道了酸的離解常數Ka,就可以計算出它的共軛鹼的Kb,反之亦然。Ka和Kb是成反比的,而Ka和Kb正是反映酸和鹼的強度,所以,在共軛酸鹼對中,酸的強度愈大,其共軛鹼的強度愈小;鹼的強度愈大,其共軛酸的強度愈小。
一些共軛酸鹼對的強度次序。
酸性增強共軛酸(HB)Ka(在水中)pKa(在水中)共軛鹼(B)鹼性增強
| 酸性增強 | 共軛酸(HB) | Ka(在水中) | pKa(在水中) | 共軛鹼(B) | 鹼性增強 |
| H3O+ | H2O | ||||
| H2C2O4 | 5.4×10-2 | 1.27 | HC2O-4 | ||
| H2SO3 | 1.54×10 | 1.81 | HSO-3 | ||
| HSO-4 | 1.20×10-2 | 1.92 | SO2-4 | ||
| H3PO4 | 7.51×10-3 | 2.12 | H2PO-4 | ||
| HNO2 | 4.6×10-4 | 3.37 | NO-2 | ||
| HF | 3.53×10-4 | 3.45 | F- | ||
| HCOOH | 1.77×10-4 | 3.75 | HCOO- | ||
| HC2O-4 | 5.4×10-5 | 4.27 | C2O2-4 | ||
| CH3COOH | 1.76×10-5 | 4.75 | CH3COO- | ||
| H2CO3 | 4.30×10-7 | 6.37 | HCO-3 | ||
| HSO-3 | 1.02×10-7 | 6.91 | SO2-3 | ||
| H2S | 9.1×10-8 | 7.04 | HS- | ||
| H2PO-4 | 6.23×10-8 | 7.21 | HPO2-4 | ||
| NH+4 | 5.68×10-10 | 9.25 | NH3 | ||
| HCN | 4.93×10-10 | 9.31 | CH- | ||
| HCO-3 | 5.61×1011 | 10.25 | CO2-3 | ||
| H2O2 | 2.4×10-12 | 11.62 | HO-2 | ||
| HS- | 1.1×10-12 | 11.96 | S2- | ||
| HPO2-4 | 2.2×10-13 | 12.67 | PO3-4 | ||
| H2O | OH- |
酸鹼反應
酸鹼質子理論中的酸鹼反應是酸鹼之間的質子傳遞。
這個反應無論在水溶液中、苯或氣相中,它的實質都是一樣的。HCL是酸,放出質子給NH3,然後轉變成共軛鹼CL-,NH3是鹼,接受質子後轉變成共軛酸NH4+。強鹼奪取了強酸放出的質子,轉化為較弱的共軛酸和共軛鹼。
酸鹼質子理論不僅擴大了酸鹼的範圍,還可以把酸鹼離解作用、中和反應、水解反應等,都看作是質子傳遞的酸鹼反應。
由此可見,酸鹼質子理論更好地解釋了酸鹼反應,擺脫了酸鹼必須在水中才能發生反應的局限性,解決了一些非水溶劑或氣體間的酸鹼反應,並把水溶液中進行的某些離子反應系統地歸納為質子傳遞的酸鹼反應,加深了人們對酸鹼和酸鹼反應的認識。但是酸鹼質子理論不能解釋那些不交換質子而又具有酸鹼性的物質,因此它還存在著一定的局限性。
酸鹼理論
布朗斯特(Brönsted)和勞萊(Lowry)在1923年提出的質子理論認為,凡是給出質子(H+)的任何物質(分子或離子)都是酸;凡是接受質子(H+)的任何物質都是鹼。簡單地說,酸是質子的給予體,而鹼是質子的接受體。酸和鹼之間的關係表示如下:
酸質子(H+)+鹼
按照酸鹼質子理論,屬於酸的有:HCL、HAC、NH4-、[AL(H2O)6]、H2PO4-、HPO42-等。屬於鹼的有:NH3、[AL(H2O)5OH]2+、CL-、AC-、HPO42-、PO43-等。同時還可以看出,酸和鹼是統一在對質子的關係上:酸放出質子後變成了鹼,而鹼接受質子後就變成了酸。為了表示它們之間的聯繫,常把酸鹼之間的這種關係叫做共軛酸鹼對。酸放出質子後形成的鹼,叫做該酸的共軛鹼;鹼接受質子後形成的酸,叫做該鹼的共軛酸。我們把相差一個質子的對應酸鹼,叫做共軛酸鹼。
根據酸鹼的質子理論,容易放出質子(H+)的物質是強酸,而該物質放出質子後形成的鹼就不容易同質子結合,因而是弱的鹼。換言之,酸越強,它的共軛鹼就越弱;反之,鹼越強,它的共軛酸就越弱。
酸鹼質子理論擴大了酸鹼的含義及酸鹼反應的範圍,擺脫了酸鹼必須發生在水中的局限性,解決了非水溶液或氣體間的酸鹼反應,並把在水溶液中進行的解離、中和、水解等類反應概況為一類反應,即質子傳遞式的酸鹼反應。但是,該理論也有它的缺點,例如,對不含氫的一類化合物的酸鹼性問題,卻無能為力。