 分子免疫學
分子免疫學簡介
 分子免疫學
分子免疫學另外,對抗原的研究也取得很大的成績,如已能從微生物中提取各種保護性抗原製備化學疫苗。在細胞抗原方面,也已弄清紅細胞血型抗原的化學組成;對組織相容性複合體(MHC)產物,特別是對小鼠H-2抗原和人白血細胞抗原 (HLA)的分離純化和化學分析都取得了顯著的進展;對人的腫瘤相關抗原如甲胎蛋白(α-FP)癌胚抗原 (CEA)的提取和純化均已成功。由於在分子水平上了解抗原和抗體,對抗原抗體反應的特異性就有了進一步的認識。在這方面起決定性作用的是構型的互補性:對線性抗原來說,抗原決定簇的一級結構比較重要;而對球形抗原來說,抗原決定簇的立體結構比較重要。
在對補體的研究方面,分子免疫學也有突出的成就,如人們已經能夠分離和提取補體系統的各個成分,分析某些補體成分的分子結構和胺基酸序列。對調控免疫應答的其他生物學活性因子 (如淋巴因子、胸腺因子、轉移因子和免疫核糖核酸等)的分離和理化性質的研究,也都取得顯著的進展。
酶聯免疫吸附實驗
 分子免疫學
分子免疫學在測定時,把受檢標本(測定其中的抗體或抗原)和酶標抗原或抗體按不同的步驟與固相載體表面的抗原或抗體起反應。用洗滌的方法使固相載體上形成的抗原抗體複合物與其他物質分開,最後結合在固相載體上的酶量與標本中受檢物質的量成一定的比例。加入酶反應的底物後,底物被酶催化變為有色產物,產物的量與標本中受檢物質的量直接相關,故可根據顏色反應的深淺刊物定性或定量分析。由於酶的催化頻率很高,故可極大地地放大反應效果,從而使測定方法達到很高的敏感度。
免疫組織化學技術
免疫組織化學又稱免疫細胞化學,是指帶顯色劑標記的特異性抗體在組織細胞原位通過抗原抗體反應和組織化學的呈色反應,對相應抗原進行定性、定位、定量測定的一項新技術。它把免疫反應的特異性、組織化學的可見性巧妙地結合起來,藉助顯微鏡(包括螢光顯微鏡、電子顯微鏡)的顯像和放大作用,在細胞、亞細胞水平檢測各種抗原物質(如蛋白質、多肽、酶、激素、病原體以及受體等)。
免疫組化技術近年來得到迅速發展。50年代還僅限於免疫螢光技術,50年代以後逐漸發展建立起高度敏感,且更為實用的免疫酶技術。
免疫球蛋白
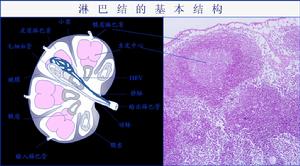 分子免疫學
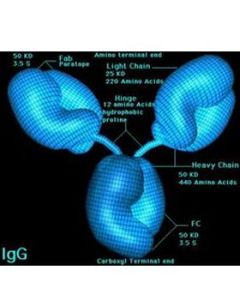
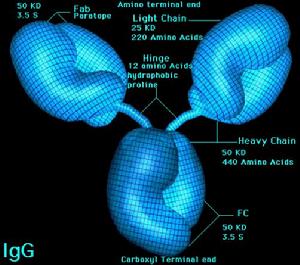
分子免疫學四肽鏈結構 所有Ig的基本單位都是四條肽鏈的對稱結構。兩條重鏈(H)和兩條輕鏈(L)。每條重鏈和輕鏈分為氨基端和羧基端。
人類Ig根據其重鏈穩定區的分子結構和抗原特異性的不同,分為五類:IgG、IgA、IgM、IgD、IgE,其重鏈分別為:γ、α、μ、δ、ε
輕鏈可分為兩型:κ、λ型
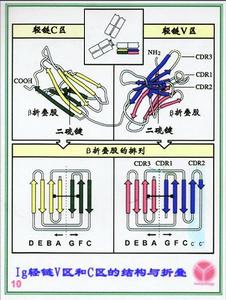
可變區根據胺基酸排列順序的不同分為可變區(V)和恆定區(C)。 比較不同抗體V區的胺基酸序列,發現VH和VL各有3個區域的胺基酸組成和排列順序特別易變化,這些區域稱為高變區。三個高變區共同組成Ig的抗原結合部位,該部位也稱為互補性決定區
恆定區重鏈和輕鏈的C區分別稱為CH和CL,不同類Ig的重鏈CH長度不一,同一種屬動物中,同一類別Ig分子C區胺基酸的組成和排列順序比較恆定。
鉸鏈區位於CH1與CH2之間,含有豐富的脯氨酸,因此易伸展彎曲,而且易被木瓜蛋白酶、胃蛋白酶等水解。
免疫耐受
 分子免疫學
分子免疫學