病發條件
因而有下列情況之一者,耐受將形成:
1.外來抗原具有與機體表面抗原相同的表位。
2.在胚胎時期未建立與淋巴細胞接觸,即人體免疫隔離部位(如眼晶狀體蛋白等在正常情況下被屏障隔離於免疫系統之外,若因外傷溢出接觸淋巴細胞,可誘導強免疫應答,導致交感性眼炎)。
3.機體免疫系統有缺陷,使得具調節作用的淋巴細胞生成有障礙。
現象
按照免疫耐受形成的特點,可分為天然與獲得兩種。
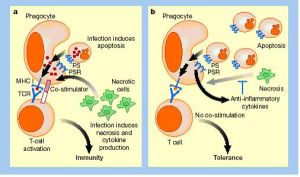 免疫耐受
免疫耐受免疫耐受既可天然獲得,亦可人工誘導。前者稱天然耐受(naturaltolerance),後者稱獲得耐受(acpuiredtolerance)。外來的或自身的抗原均可誘導免疫耐受,這些抗原稱耐受原(tolerangen)。針對自身抗原呈現的免疫耐受(self tolerance)。
按照免疫耐受的程度,又可分為完全耐受和不完全耐受。後者又有多種形式。如僅對T細胞或B細胞產生的耐受分別稱T細胞耐受或B細胞耐受。又如免疫活性細胞僅對抗原分子上的某一特定決定簇產生耐受而不涉及對其它決定簇的應答,這些現象稱為分離耐受(splittolerance)。不完全耐受尚可表現為抗體分泌細胞在再次受抗原刺激後,產生低親和力抗體或缺失抗體類別轉換,是為免疫偏離(immune deviation)。
一、天然耐受現象
1945年Owen觀察到異卵雙生小牛胎盤血管融合,血液交流而呈自然的聯體共生,可在一頭小牛的血液中同時存在有兩種不同血型抗原的紅細胞,成為血型鑲嵌體(chimeras)。這種小牛不但允許抗原不同的血細胞在體內長期存在,不產生相應抗體,而且還能接受雙胞胎另一小牛的皮膚移植而不產生排斥反應。但是不能接受其他無關個體的皮膚移植。Owen稱這一現象為天然耐受。Burnet等人認為異卵雙生牛體內,對異型血細胞的耐受現象的產生是由於胚胎期免疫功能尚未成熟,異型血細胞進入胚胎牛體內,能引起對異型細胞產生抗體的免疫細胞克隆受抑制或被消滅,故此小牛出生後對胚胎期接觸過的異型紅細胞抗原不會發生免疫應答。根據這個理論,不少人進行了誘導實驗性耐受工作。
二、實驗誘導的耐受性
1953後Medawar等將CBA系黑鼠的淋巴細胞接種入A系白鼠的胚胎內,待A系白鼠出生8周后,將CBA黑鼠的皮膚植至該A系白鼠體上,可存活不被排斥。這一實驗證實了胚胎期接觸抗原物質,出生後對該抗原就有特異的免疫耐受現象。這一發現使人們對於耐受機制的認識有了重大的突破,提示胚胎期接觸抗原將導致耐受。其後又證明在成年動物也可引起免疫耐受性,但較胚胎期困難的多。
影響因素
抗原性物質進入機體後,有時導致正相免疫應答,有時導致免疫耐受或負
 免疫耐受
免疫耐受相免疫應答。這兩種不同免疫應答的出現,取決於諸多因素的影響,而主要與抗原物質及機體兩方面的因素有關。
一、抗原方面的因素
(一)抗原的性質
耐受原僅是一個功能性定義,有許多因素可影響某抗原使之成為免疫原或耐受原。例如牛或人的丙種球蛋白(BGG、HGG)呈大分子聚合狀態時具免疫原性,而分子較小的非聚合單體則是良好的耐受原。給動物注射這種耐受原後,對以後再注入的聚合丙種球蛋白表現為無應答。一般來說分子量小的抗原其免疫原性差,導致耐受能力強,並隨分子量大小而遞減或遞增。例如多聚鞭毛素(分子量104KD)、單體鞭毛素(分子量40KD)及由單體鞭毛素提取的成分A(分子量18kD)三者的免疫原性依次遞減,而致耐受原性則依次遞增。
此外,可溶性抗原常為致耐原,而顆粒性抗原則易於引起正相免疫應答。易被吞噬細胞迅速攝取的抗原常誘發免疫應答,而緩慢或不易被吞噬細胞攝取的抗原則多為致耐原。抗原表位密度高,即抗原分子表面具有許多相同重複的抗原決定簇者,其致耐原強。
(二)抗原的劑量
足以誘導耐受的抗原劑量隨抗原種類、動物的種屬、品系及年齡、且參與效應細胞類型等的不同而有所差異。一般來說,抗原劑量越大所誘導的耐受越完全和持久。
Mitchison在1964年首先報告高、低帶耐受性(high-zone,low-xone tolerance)現象。當他給小鼠注射低劑量(10-8M)與高劑量(10-5M)牛血清白蛋白(BSA)後,動物出現耐受。而中等劑量(10-7M)BSA引起良好的免疫應答。
T、B細胞產生耐受所需抗原劑量明顯不同。T細胞所需抗原量較B細胞要小100-10000倍,而且發生快(24小時內達高峰),持續長(數月)。而B細胞形成耐受不但需要抗原量大,且發生緩慢(1-2周),持續時間短(數周)。
Waigle研究指出,小劑量抗原引起T細胞耐受,而大劑量抗原則引起T細胞和B細胞都耐受。
致耐受所需抗原量與個體的年齡有關,即隨年齡相應增大。與抗原的類別亦有關,即強免疫原性抗原大量注入時能引起耐受,繼續注入大量抗原使耐受性增強;胸腺非依賴抗原高劑量易致耐受,胸腺依賴抗原用高、低劑量均可引起耐受。
(三)抗原注射途徑
一般來說,抗原經靜脈注射最易誘導耐受性,腹腔注射次之,皮下及肌肉注射最難。但不同的部位靜脈注射引起後果可各異。HGG經頸靜脈注入引起免疫,腸系膜靜脈注入引起耐受;IgG或白蛋白注入靜脈能致耐受,注入周圍靜脈則引起免疫應答。有些半抗原經皮內注射能誘導抗體生成及遲髮型變態反應,但通過口服則發生耐受性。
通過腸系膜及門靜脈注射易於致耐受的原因可能是由於肝起著生物學過濾的作用,將抗原解聚,聚合抗原被肝內枯否細胞吞噬降解,從而除去了免疫原性強的抗原部分,剩下非聚合抗原進入外周血流或淋巴道。
二、機體因素
(一)年齡因素
年齡與耐受易感程度密切相關。Owen與Billingham等人的資料表明胚胎期與新生期的免疫系統接觸抗原(不論是天然或人工的)後,極易導致終生或長期的耐受性。其後,許多實驗證實這一現象的普遍性。這主要與免疫系統發育未成熟有關,體外實驗證明未成熟細胞大30倍以上。成年機體一般亦不易誘導耐受,常須聯合套用其他免疫抑制措施,以加速其誘導過程。
(二)遺傳因素
小鼠免疫耐受及維持的難易程度隨品系不同而異。自身免疫病好發鼠(NZB×NAW)F1品系難於誘導耐受,所誘導出的耐受性維持時間短。所有自發產生類似人類系統性紅斑狼瘡(SLE)品系小鼠不易用半抗原或非聚合的免疫球蛋白誘發耐受。
(三)免疫抑制的聯合套用
前已提及,單獨使用抗原一般不易對成年機體誘發耐受性,而常需要與各種免疫抑制措施聯合套用。常用的有效方法是全身淋巴組織照射,套用抗淋巴細胞血清(anti-lym-phocyte serum,ALS),抗TH細胞抗體(人抗CD4、小鼠抗L3T4),環磷醯胺,環孢素A,糖類皮質激素等免疫抑制藥物。
上述現象不僅已被許多實驗所證明,而且在器官移植臨床工作中已被證實是延長移植物存活的有效措施,認為是常規防止移植物排斥的方法。
單純免疫抑制藥物並不能誘導出抗原特異性的免疫耐受。這些藥物必須與抗原聯合套用,在免疫耐受形成過程中起促進作用,降低耐受原劑量,阻斷抗原刺激後免疫活性細胞的分化。
例如環磷醯對抗原誘導免疫耐受有促進作用。現已證明,環磷醯胺同時作用於T及B細胞。它參與免疫耐受誘導的機制可能與其阻止B細胞表面免疫蛋白受體的再生有關。
又如全身淋巴組織照射時用鉛板遮蔽骨髓、肺及其他生命重要的非淋巴器官,因此劑量即使高達40戈瑞(Cy)亦無副反應。這種處理可使機體胸腺及二級淋巴器官中已成熟的淋巴細胞受到破壞,造成類似新生期的狀態。此時胸腺和二級淋巴器官中未成熟的淋巴細胞可重新形成集落,細胞表面雖有抗原受體表達但尚未發育成熟。因此,全身淋巴組織照射後能用多種抗原誘導出持久的免疫耐受,如輸注同種異體骨髓能建立起同種骨髓嵌合體且不發生移植物抗宿主病。這種情況下,耐受性的維持與體內產生特異性的抑制細胞有關,稱為天然抑制細胞。這種細胞見於新生及照射過的動物脾內,它們不具有通常T細胞表面標誌,表型類似NK細胞,但對NK細胞敏感的靶細胞並無殺傷作用。
臨床意義
首先,免疫耐受的誘導、維持和破壞影響著許多臨床疾病的發生、
 免疫耐受
免疫耐受發展和轉歸。人們企圖誘導和維持免疫耐受性來防治超敏性疾病、自身免疫性疾病以及移植物的排斥反應。某些感染性疾病以及腫瘤生長過程中,設法解除免疫耐受、激發免疫應答將有利於對病原體的清除及腫瘤的控制。
根據免疫耐受發生機制的多樣性,對Ⅰ型變態反應患者誘導免疫耐受的可能途徑是通過B克隆清除或主動抑制。處理的方法有注射表面高密度多聚耐受原、變性蛋白抗原或脫敏療法等。
自身免疫病的發生至今認為主要與自身耐受的破壞有關,去除導致耐受破壞的因素,當然有利於對自身免疫病的防治。
現代醫學雖然已將古人幻想的器官移植變為現實,但同種異體免疫排斥現象仍是器官移植中主要存在的問題。免疫抑制療法上的進步有利於延長移植物存活,但非特異抑制所帶來的副作用仍有待解決。若能將特異抑制(免疫耐受)成功地套用於臨應,收到較好的效果,無疑是在此領域中的重大突破。
在麻風及慢性黏膜皮膚念珠菌病患者中,若體內出現良好的細胞免疫應答,雖抗體生成低下或甚至缺如,臨床預後仍良好,並常伴隨有效的防禦性免疫。反之,如細胞免疫水平低下,抗體效價雖高,而預後較差,多呈進行性感染。這種分離耐受現象對感染性疾病的預後有重要影響。B型肝炎病毒攜帶者伴有極輕微的肝炎病變,可能與新生期發生感染而使機體對病毒產生部分耐受性有關。
在對腫瘤患者的免疫治療中,解除患者的免疫耐受狀態也是一項有意義的措施。美國兩家實驗室報導將一種協同刺激因子B7的基因轉染黑色素瘤細胞,並用這種轉染細胞進行防治黑色素瘤的實驗性研究,獲得可喜的成功。為這一領域的研究開闊了新的途徑。