 雜交分子示意圖
雜交分子示意圖分子雜交技術(molecular hybridization)是在研究DNA分子復性變化基礎上發展起來的一種技術。其原理是,具有互補核苷酸序列的兩條單鏈核苷酸分子片段,在適當條件下,通過氫鍵結合,形成DNA-DNA,DNA-RNA或RNA-RNA雜交的雙鏈分子。這種技術可用來測定單鏈分子核苷酸序列間是否具有互補關係。
DNA分子雜交就是具有互補脫氧核苷酸序列的兩條單鏈核苷酸分子片段,在適當條件下,通過氫鍵結合,形成DNA-DNA雙鏈。具備的條件就是兩條單鏈DNA的脫氧核苷酸序列互補。
概述
分子雜交可在dna與dna、rna與rna或rna與dna的二條單鏈之間進行。由於dna一般都以雙鏈形式存在,因此在進行分子雜交時,應先將雙鏈dna分子解聚成為單鏈,這一過程稱為變性,一般通過加熱或提高ph值來實現。使單鏈聚合雙鏈的過程稱為退火或復性。用分子雜交進行定性或定量分析的最有效方法是將一種核酸單鏈用同位素或非同位素標記成為探針,再與另一種核酸單鏈進行分子雜交。
核酸雜交技術基本上是hall等1961年的工作開始的,探針與靶序列在溶液中雜交,通過平衡密度梯度離心分離雜交體。該法很慢、費力且不精確,但它開拓了核酸雜交技術的研究。bolton等1962年設計了第一種簡單的固相雜交方法,稱為dna-瓊脂技術。變性DNA固定在瓊脂中,dna不能復性,但能與其它互補核酸序列雜交。典型的反應是用放射性標記的短dan或rna分子與膠中dna雜交過夜,然後將膠置於柱中進行漂洗,去除游離探針,在高溫、低鹽條件下將結合的探針洗脫,洗脫液的放射性與結合的探針量呈正比。該法尤其適用於過量探針的飽和雜交實驗。60年代末,britten等設計了另一種分析細胞基因組的方法。該法是研究液相中dna的復性以比較不同來源核酸的複雜度,典型的方法是:從不同生物體(細菌、酵母、魚和哺乳動物等)內分離dna,用水壓器剪下成長約450核苷酸(nt)的片段。剪下的dna液(含0.12mol/l磷酸鹽緩衝液或0.18mol/l na+),經煮沸使dsdna熱變性成 ssDNA。然後冷至約60℃,在此溫度孵育過程中,測定溶液一定時間內的uv260nm的吸光度(減色效應)來監測互補鏈的復性程度。通常該實驗可比較不同來源生物dna的復性速率,並可建立序列複雜度與動力學複雜度間的關係。
60年代中期nygaard 等的研究為套用標記dna或rna探針檢測固定在硝酸纖維素(nc)膜上的dna序列奠定了基礎。如brown等套用這一技術評估了爪蟾rrna基因的拷貝數。rna在代謝過程中被3h尿嘧啶標記,並在過量的情況下與膜上固定的基因組dna雜交,繼而用rnase處理,消化非特異性結合的rna。漂洗後計數以測定雜交探針的量。通過計算與已知量dna雜交的rna量即可評估rrna基因數。由於當時缺乏特異探針,這種方法不能用於研究其它特異基因的表達,這些早期過量探針膜雜交試驗實際上是現代膜雜交實驗的基礎。
進入70年代早期,許多重要的發展促進了核酸雜交技術的進展。例如,對特異基因轉錄產物的分析和對動力學雜交實驗又有興趣。固相化的poly u –sepharose和寡(dt)-纖維素使人們能從總rna中分離poly a+ rna。用mrna的經純化技術可從網織紅細胞總rna中製備α-和β-珠蛋白mrna混合物。這些珠蛋白mrna首次被用於合成特異的探針以分析珠蛋白基因的表達。由於製備cdna探針很繁瑣,所獲得cdna的長度和純度也不穩定。所以尋求新的探針來源是使分子雜交技術進一步推廣的基礎。
70年代末期到80年代早期,分子生物學技術有了突破性進展,限制性內切酶的發展和套用使分子克隆成為可能。各種載體系統的誕生,尤其是質粒和噬菌體dan載體的構建,使特異性dna探針的來源變得十分豐富。人們可以從基因組dna文庫和cdna文庫中獲得特定基因克隆,只需培養細菌,便可提取大量的探針dna。迄今為止,已克隆和定性了許多特異dna探針 。
由於固相化學技術和核酸自動合成儀的誕生,現在可常規製備18~100個鹼基的寡核苷酸探針。套用限制酶和southern印跡技術,用數微克dna就可分析特異基因。特異dna或rna序列的量和大小均可用southern印跡和northern印跡來測定 ,與以前的技術相比,大大提高了雜交水平和可信度。
儘管取得了上述重大進展,但分子雜交技術在臨床實用中仍存在不少問題,必須提高檢測單拷貝基因的敏感性,用非放射性物質代替放射性同位素標記探針以及簡化實驗操作和縮短雜交時間,這樣,就需要在以下三方面著手研究:第一,完善非放射性標記探針;第二,靶序列和探針的擴增以及信號的放大;第三,發展簡單的雜交方式,只有這樣,才能使dna探針實驗做到簡便、快速、低廉和安全。
探針-靶反應
從化學和生物學意義上理解,探針是一種分子,它帶有供反應後檢測的合適標記物,並僅與特異靶分子反應。抗原-抗體、外源凝集素-碳水化合物、親和素-生物素、受體-配基(ligand)以及互補核酸間的雜交均屬於探針-靶分子反應。蛋白質探針(如抗體)與特異靶分子是通過混合力(疏水、離子和氫鍵)的作用在少數特異位點上的結合,而核酸探針與互補鏈的反應則是根據雜交體的長短不同,通過氫鍵在幾十、幾百甚至上千個位點上的結合。因為有機溶液可降低雜交體的穩定性,所以,疏水反應對互補核酸鏈的結合也有一定的作用,但對其特異性影響甚微。
核苷酸經某一原子、功能基團或長側鏈修飾後仍可能進行鹼基配對, 這取決於修飾的部位和修飾的性質。這一特性有助於理解非放射性核酸探針標記物的設計和125i與dna探針的化學結合。能與核酸結合的單一原子有銀、溴和碘等,這些元素可與嘧啶(胸腺嘧啶除外)環的c-5位或嘌呤環的c-8位反應而不影響氫鍵的形成。溴亦可與胸腺嘧啶的c-6位結合。而胞嘧啶的c-4和腺嘌呤的n-6就不能被修飾,否則會影響鹼基配對,儘管c的n-4位和a的n-6位參與了氫鍵形成,但它們也是標記位點。這是因為標記的探針每1kb只摻入10~30個修飾鹼基,即僅4%~12%的單個鹼基被修飾的類似物取代了。儘管摻入位點處的鹼基配對較弱或不存在,但對整個雜交分子的穩定性影響很小。防止氫鍵破壞的一種方法就是修飾探針,即探針克隆入m13載體中,只修飾載體區而不修飾插入片段。當用放射性同位素32p和35s標記核酸時,由於同位素是摻入核酸骨架的磷酸二脂鍵中,因此鹼基未發生任何修飾。在5’端的磷酸基團上可進行化學修飾,這是標記寡核苷酸探針的有效方法。因為這種方法是在一個探針分子上標記一個檢測的基團,所以,對長的克隆探針不適用。
此外,還可利用修飾的鹼基來增加雜交的穩定性和特異性。2-氫基腺嘌呤可替代寡核苷酸探針中的腺嘌呤通過形成3個氫鍵以增加雜交體的穩定性。另外,在g-c豐富的rna探針中,可用次黃嘌呤代替鳥嘌呤以獲得特異的雜交。因為次黃嘌呤和鳥嘌呤間只形成2個氫鍵,有效地降低了雜交體的tm值,這樣,tm值與雜交溫度更接近,雜交的嚴格性就增加了,因此,也就增加了特異性。
很顯然,結合位點的不同和可檢測基團與檢測系統的不同,可派生出很多核酸探針標記方法。這是由核酸的化學結構和性質所決定的。
核酸探針的種類
基因探針根據標記方法不同可粗分為放射性探針和非放射性探針兩大類,根據探針的核酸性質不同又可分為dna探針,rna探針,cdna探針,cRNA探針及寡核苷酸探針等幾類,dna探針還有單鏈和雙鏈之分。下面分別介紹這幾種探針。
(一)dna探針
dna探針是最常用的核酸探針,指長度在幾百鹼基對以上的雙鏈dna或單鏈dna探針。現已獲得dna探針數量很多,有細菌、病毒、原蟲、真菌、動物和人類細胞dna探針。這類探針多為某一基因的全部或部分序列,或某一非編碼序列。這些dna片段須是特異的,如細菌的毒力因子基因探針和人類alu探針。這些dna探針的獲得有賴於分子克隆技術的發展和套用。以細菌為例,目前分子雜交技術用於細菌的分類和菌種鑑定比之g+c百分比值要準確的多,是細菌分類學的一個發展方向。加之分子雜交技術的高敏感性,分子雜交在臨床微生物診斷上具有廣闊的前景。細菌的基因組大小約5×106bp,約含3000個基因。各種細菌之間絕大部分dna是相同的,要獲得某細菌特異的核酸探針,通常要採取建立細菌基因組dna文庫的辦法,即將細菌dna切成小片段後分別克隆得到包含基因組的全信息的克隆庫。然後用多種其它菌種的dna作探針來篩選,產生雜交信號的克隆被剔除,最後剩下的不與任何其它細菌雜交的克隆則可能含有該細菌特異性dna片段。將 此重組質粒標記後作探針進一步鑑定,亦可經dna序列分析鑑定其基因來源和功能。因此要得到一種特異性dna探針,常常是比較繁瑣的。探針dna克隆的篩選也可採用血清學方法,所不同的是所建dna文庫為可表達性,克隆菌落或噬斑經裂解後釋放出表達抗原,然後用來源細菌的多克隆抗血清篩選陽性克隆,所得到多個陽性克隆再經其它細菌的抗血清篩選,最後只與本細菌抗血清反應的表達克隆即含有此細菌的特異性基因片段,它所編碼的蛋白是該菌種所特有的。用這種表達文庫篩選得到的顯然只是特定基因探針。
對於基因探針的克隆尚有更快捷的途徑。這也是許多重要蛋白質的編碼基因的克隆方法。該方法的第一步是分離純化蛋白質,然後測定該蛋白的氨基或羥基末端的部分胺基酸序列,然後根據這一序列合成一套寡核苷酸探針。用此探針在dna文庫中篩選,陽性克隆即是目標蛋白的編碼基因。值得一提的是真核細胞和原核細胞dna組織有所不同。真核基因中含有非編碼的內含子序列,而原核則沒有。因此,真核基因組dna探針用於檢測基因表達時雜交效率要明顯低於cdna探針。
dna探針(包括cdna探針)的主要優點有下面三點:①這類探針多克隆在質粒載體中,可以無限繁殖,取之不盡,製備方法簡便。②dna探針不易降解(相對rna而言),一般能有效抑制dna酶活性。③dna探針的標記方法較成熟,有多種方法可供選擇,如缺口平移,隨機引物法,PCR標記法等,能用於同位素和非同位素標記。
(二)cdna探針
cdna(complementary dna)是指互補於mrna的dna分子。cdna是由rna經一種稱為逆轉錄酶(reverse transcriptase)的dna聚合酶催化產生的,這種逆錄酶是temin等在70年代初研究致癌rna病毒時發現的。該酶以rna為模板,根據鹼基配對原則,按照rna的核苷酸順序合成dna(其中u與a配對)。這一途徑與一般遺傳信息流的方向相反,故稱反向轉錄或逆轉錄。攜帶逆轉錄酶的病毒侵入宿主細胞後,病毒rna在逆轉錄酶的催化下轉化成雙鏈cdna,並進而整合人宿主細胞染色體dna分子,隨宿主細胞dna複製同時複製。這種整合的病毒基因組稱為原病毒。在靜止狀態下,可被複製多代,但不被表達,故無毒性。一旦因某種因素刺激而被活化,則該病毒大量複製,如其帶有癌基因,還可能誘發細胞癌變,後來發現逆轉錄酶不僅普遍存在於rna病毒中,而且哺乳動物的胚胎細胞和正在分裂的淋巴細胞也含有逆轉錄酶。逆轉錄酶的作用是以dntp為底物,rna為模板,trna(主要是色氨酸trna)為引物,在trna3’-oh末端上, 5’-3’方向,合成與rna互補的dna單鏈,稱為互補dna(cdna),單鏈cdna與模板rna形成rna-dna雜交體。隨後在逆轉錄酶的rnase h活性作用下,將rna鏈水解成小片段。cdna單鏈的3’末端回折形成一個小引物末端,逆轉錄酶又以第一條cdna鏈為模板再合成第二第cdna鏈,至此,完成逆轉錄全過程,合成雙鏈cdna。
逆轉錄現在已成為一項重要的分子生物學技術,廣泛用於基因的克隆和表達。從逆轉錄病毒中提取的逆轉錄酶已商品化,最常用的有amv逆轉錄酶。利用真核mrna3’末端存在一段聚腺苷酸尾,可以合成一段寡聚胸苷酸(Oligo(dT))用作引物,在逆轉錄酶催化下合成互補於mrna的crna鏈,然後再用rnase h將mrna消化掉,再加入大腸桿菌的DNA聚合酶I催化合成另一條dna鏈,即完成了從mrna到雙鏈dna的逆轉錄過程。
所得到的雙鏈cdna分子經s1核酸酶切平兩端後接一個有限制酶切點的接頭(linker),再經特定的限制酶消化產生粘性末端,即可與含互補末端的載體進行連線。常用的克隆載體是λ噬菌體dna,如λgt,embl和Charon系列等。用這類載體可以得到包含104以上的轉化子的文庫,再經前面介紹的篩選方法篩選特定基因克隆。用這種技術獲得的dna探針不含有內含子序列。因此尤其適用於基因表達的檢測。
(三)rna探針
rna探針是一類很有前途的核酸探針,由於rna是單鏈分子,所以它與靶序列的雜交反應效率極高。早期採用的rna探針是細胞mrna探針和病毒rna探針,這些rna是在細胞基因轉錄或病毒複製過程中得到標記的,標記效率往往不高,且受到多種因素的制約。這類rna探針主要用於研究目的,而不是用於檢測。例如,在篩選逆轉錄病毒人類免疫缺陷病毒(hiv)的基因組dna克隆時,因無dna探針可利用,就利用hiv的全套標記mrna作為探針,成功地篩選到多株hiv基因組dna克隆。又如進行中的轉錄分析(nuclear run on transcrip-tion assay)時,在體外將細胞核分離出來,然後在α-32p-atp的存在下進行轉錄,所合成mr-na均摻入同位素而得到標記,此混合mrna與固定於硝酸纖維素濾膜上的某一特定的基因的dna進行雜交,便可反映出該基因的轉錄狀態,這是一種反向探針實驗技術。
近幾年體外轉錄技術不斷完善,已相繼建立了單向和雙向體外轉錄系統。該系統主要基於一類新型載體psp和pgem,這類載體在多克隆位點兩側分別帶有sp6啟動子和t7啟動子,在sp6rna聚合酶或t7 rna聚合酶作用下可以進行rna轉錄,如果在多克隆位點接頭中插入了外源dna片段,則可以此dna兩條鏈中的一條為模板轉錄生成rna。這種體外轉錄反應效率很高,在1h內可合成近10μg的rna產生,只要在底物中加入適量的放射性或生物素標記的ntp,則所合成的rna可得到高效標記。該方法能有效地控制探針的長度並可提高標記物的利用率。
值得一提的是,通過改變外源基因的插入方向或選用不同的rna聚合酶,可以控制rna的轉錄方向,即以哪條dna鏈以模板轉錄rna。這種可以得到同義rna探針(與mrna同序列)和反義rna探針(與mrna互補),反義rna又稱crna,除可用於反義核酸研究外,還可用於檢測mrna的表達水平。在這種情況下,因為探針和靶序列均為單鏈,所以雜交的效率要比dna-dna雜交高几個數量級。rna探針除可用於檢測dna和mrna外,還有一個重要用途,在研究基因表達時,常常需要觀察該基因的轉錄狀況。在原核表達系統中外源基因不僅進行正向轉錄,有時還存在反向轉錄(即生成反義rna),這種現象往往是外源基因表達不高的重要原因。另外,在真核系統,某些基因也存在反向轉錄,產生反義rna,參與自身表達的調控。在這些情況下,要準確測定正向和反向轉錄水平就不能用雙鏈dna探針,而只能用rna探針或單鏈dna探針。
綜上所述,rna探針和crna探針具有dna探針所不能比擬的高雜交效率,但rna探針也存在易於降解和標記方法複雜等缺點。
(四)寡核酸探針
前述三種探針均是可克隆的,一般情況下,只要有克隆的探針,就不用寡核苷酸探針。在dna序列未知而必須首先進行克隆以便繪製酶譜和測序時,也常套用克隆。克隆探針一般較寡核苷酸探針特異性強,複雜度也高,從統計學角度而言, 較長的序列隨機碰撞互補序列的機會較短序列少,克隆探針的另一優點是,可獲得較強的雜交信號,因為克隆探針較寡核苷酸探針摻入的可檢測標記基因更多。但是,較長的探針對於靶序列變異的識別能力又有所降低。對於僅是單個鹼基或少數鹼基不同的兩序列,克隆探針不能區分 ,往往雜交信號相當。這既是其優點,又是其缺點。優點是當用於檢測病原微生物時,不會因病毒或細菌dna的少許變異而漏診,缺點則是不能用於點突變的檢測。這種情況下,通常要採用化學合成的寡核苷酸探針。
合成的寡核苷酸探針具有一些獨特的優點:①由於鏈短,其序列複雜度低,分子量小,所以和等量靶位點完全雜交的時間比克隆探針短,如20nt的寡核苷酸探針在濃度為100ng/ml,靶序列為1~100pg、1kb片段或3×10-18~3×10-16mol/l時,達到最大程度的雜交只需10min,而用2kb的克隆探針在同樣條件下達到完全雜交則需16h。②寡核苷酸探針可識別靶序列內1個鹼基的變化,因為短探針中鹼基的錯配能大幅度地降低雜交體的tm值。③一次可大量合成寡核苷酸探針(1~10mg),使得這種探針價格低廉,與克隆探針一樣,寡核苷酸探針能夠用酶學或化學方法修飾以進行非放射性標記物的標記。儘管克隆探針較特異,但通過細心篩選序列和/或選擇相對長的序列(>30nt)亦可設計出非常特異的寡核苷酸探針。最常用的寡核苷酸探針有18~40個鹼基,目前的合成儀可有效地合成至少50個鹼基的探針。下面是篩選寡核苷酸針的一些原則。
①長18~50nt,較長探針雜交時間較長,合成量低;較短探針特異性會差些。
②鹼基成分:g+c含量為40%~60%,超出此範圍則會增加非特異雜交。
③探針分子內不應存在互補區,否則會出現抑制探針雜交的“髮夾”狀結構。
④避免單一鹼基的重複出現(不能多於4個),如-ccccc-。
⑤一旦選定某一序更符合上述標準,最好將序列與核酸庫中核酸序列比較,探針序列應與含靶序列的核酸雜交,而與非靶區域的同源性不能超過70%或有連續8個或更多的鹼基的同源,否則,該探針不能用。
按上述原則選出的探針會增加成功的機會,選定後進行合成與標記,並摸索合適的雜交條件。方法是製備幾張點有特異靶dna和不相關dna的膜,各膜分別在不同溫度下與探針雜交,特異靶dna雜交信號強而非特異dna不產生任何雜交反應的就是最適雜交溫度。 在進行點突變檢測雜交的反應時,洗膜條件和溫度物選擇往往更為重要。所選漂洗條件必需使野生型靶dna與探針產生強的雜交信號而突變型靶dna則不產生雜交信號,這可以通過逐漸提高洗膜溫度來完成。
寡核苷酸探針還有一個重要用途。在用於檢測單個鹼基差異時尚可採用一種稱為寡核苷酸限制(oligonucleotide restriction)的技術。該技術只有在突變點位於某一限制性內切酶識別位點時才有效。例如,鐮刀狀紅細胞貧血是因β珠蛋白基因的第6個寡碼子由gag變成gtg,從而導致所編碼胺基酸由酪氨酸變成纈氨酸。突變的β-珠蛋白功能異常,稱作s珠蛋白,而野生型稱為a珠蛋白,其基因型分別為βs和βa。恰好突變點a→t位於del i的識別序列ct-nag之內,這就為設計寡核苷酸限制實驗創造了條件。方法是合成一個長40個鹼基的寡核苷酸探針,其5’末端距突變鹼基有11個鹼基,該探針與βa基因的非編碼鏈互補。將此探針的5’末端標記上32p。雜交方法採用液相雜交法,即在液相中將靶dna變性解鏈,然後與探針退火,產生雜交體。如靶dna為βa型,則兩條鏈完全互補,並產生dde i的酶切位點;如待檢dna為βs型,則所形成的雜交體中兩條鏈在突變鹼基處不配對,從而不能被del i所識別。用del i消化雜交dna,顯然βa會被切開而βs不被切開。βadna雜交體被切開後,5’端探針序列因只有8個鹼基,與雜交鏈結合不緊而解離,從而產生游離的5’端標記8核苷酸單鏈。不被切開的βs雜交體尚可被另一個限制酶hinf i消化,該酶的識別位點緊靠del i 識別位點上游。βs雜交dna經hinf i消化後,將釋出探針dna的5’末端3核苷酸小片段。βadna雜交體因已無hinf i識別序列,故而不能被hinf i消化。這樣βa和βsdna經此寡核苷酸探針雜交和del i及hinf i消化後,分別產生游離的8核苷酸(8nt)和3核苷酸(3nt) 片段,它們可以經電泳分離後進行放射自顯影而獲證實。藉此策略,可輕易將各種β珠蛋白突變型鑑別開,如純合野生型aa結果為僅有8nt片段,純合突變型ss則僅可檢出3 nt片段,而雜合子as型則兩種片段均存在。
核酸探針的標記和檢測
分子雜交是核酸鏈間鹼基配對規則的一種結合方式,是核酸的重要理化特性。利用分子雜交這一特性來對特定核酸序列進行檢測,必須將雜交鏈中的一條用某種可以檢測的分子進行標記,這條鏈就稱為核酸探針。因此,核酸探針的製備是分子雜交技術的關鍵。最早採用的也是目前最常用的核酸探針標記方法是放射性同位素標記。常用的放射性同位素有32p和35s前者能量高,信號強,最常用。放射性同位素標記探針雖然敏感度高,但卻存在輻射危害和半衰期限制(32p半衰期為14.3天,35s半衰期為87.1天,125i的半衰期為60天),3h的半衰期長達12.3年, 但它所釋放β放射線能量太低(0.018mev),只能用於組織原位雜交。由於同位素標記的探針在使用過程中存在著上述缺點,近些年來,人們在尋找非航船性標記物方面取得了很大進展,國際上已有多家公司相繼推出多種非放射性探針標記試劑盒,在國內也已具備生物素類標記物的生產能力,並有相應試劑出售。目前,非放射性標記物有下述幾類:金屬如hg,螢光物質如FITC;半抗原如地高辛;生物素;酶類如辣根過氧化物酶(hrp)。半乳糖苷酶或鹼性磷酸酶(akp)等。不同的標記物,所標記探針的方法及檢測方法也各異。下面僅就國際上較常用的,有實用價值或發展前景的幾種核酸標記方法及其顯示方法分兩方面簡述如下。
(一)核酸探針的常用酶促標記技術
1.缺口平移該技術由kelly等於1970年創立。其原理是首先用dna酶在雙鏈dna探針分子的一條鏈上製造一些缺口(nick ),缺口處會形成3’—羥基末端,這時再在大腸桿菌dna聚合酶i的催化下將核苷酸殘基加在3’-羥基上,同時,根據大腸桿菌酶dna聚合酶i的5’→3’核酸外切酶活性,此酶將缺口5’側核苷酸依次切除。其結果是在缺口平移(nick tr-anslation)。根據這個原理,如果用高強度的放射性核苷酸(通常為α-32pdatp) 置換先前存在的核苷酸,則可製備比活性高達108cpm(每分鐘計數)/μg的32p標記dna。用缺口平移法標記的dna探針能滿足大多數雜交要求。
2.dna快速末端標記大腸桿菌dna聚合酶i 經枯草桿菌蛋白酶切割可得到兩條多肽鏈,其中分子量為76kd的大片段稱為Klenow片段。該酶具有完整聚合酶i的5’→3’聚合酶活性和3’→5’核酸外切酶活性,但缺乏5’→3’核酸外切酶活性。利用klenow片段可以填補由限制酶消解dna所產生的3’凹陷末端。因此,用這種方法可以標記雙鏈dna的凹陷3’末端。用klenow片段標記末端一般只用一種[α-32p]dntp,加入反應的[α-32p]dntp取決於dna末端延伸的5’末端序列,例如,用ecor i切割dna所產生的末端用[α-32p]dntp標記。標記反應可在一種限制酶消解dna後立即進行,不需去除限制酶或使其失活,也不需更換緩衝液,具有3’延伸的dna末端不能被klenow片段有效在標記,欲標記這類分子可用t4dna聚合酶。
選用這種標記方法是為了產生可用於凝膠電泳時作大小參照物的dna片段。因為標記的dna片段與其摩爾濃度成比例,而不與片段大小成比例,在限制酶消化物中,小的和大的片段都以相同程度被標記。因此,可使用放射自顯影術確定不有被溴化乙錠染色所觀察到的大小dna帶,尤其適用於southern吸印雜交時分子量標誌物的標記。通過選擇相應標記的dntp,該法還可以只標記dna分子的一端。例如,若dna片段的兩個末端分別是bam h i和hind iii 黏膜端,在反應中只加入[α-32p]dntp或[α-32p]dgtp,使可選擇性標記兩末端之一。
3.用t4多核苷酸激酶標記dna 5’末端寡核苷酸探針或短的rna和dna探針可選用此法標記,寡核苷酸探針一般多用這種標記。t4多核苷酸激酶(polynucleotide kinase, pnk)是由T4噬菌體感染的大腸桿菌中提取的,此酶能催化atp的γ-磷酸轉移至dna或rna的5’-oh末端。在過量adp存在時,也可促進磷酸交換反應,使pnk將dna末端5’磷酸轉移到adp上生成atp,然後催化[α-32p]dntp上的標記磷酸轉移至dna的5’末端,從而使dna重新磷酸化,並藉此得到標記。顯然,pnk標記dna末端需要[γ-32p]dntp,這與前述酶促標記方法不同。通常,對於5’磷酸化的dna探針,要先用鹼性磷酸酶去掉磷酸基團,然後再用於pnk催化的5’末端標記,這樣標記效率較高。
4.隨機引物延伸這是以單鏈dna或rna模板合成高比活性32p標記探針所選用的方法。原理是使長6~8nt的寡核苷酸片段與變性的dna或rna模板退火,在dna聚合酶i或反轉錄酶的作用下,以每一個退火到模板上的寡核苷酸片段為引物引發dna鏈的合成,在反應時將[α-32p]dntp摻入合成鏈,即得到標記。變性處理後,新合成鏈(探針片段)與模板解離,即得到無數各種大小的探針dna。因為所用寡核苷酸片段很短,在低溫條件下可與模板DNA隨機發生退火反應,因此被稱為隨機引物(random primer)。這種隨機引物可用小牛胸腺dna或魚精dna製備。
用隨機引物法標記的dna探針或cdna探針比活性顯著高於缺口平移法,且結果較為穩定。這種方法尤其適用於真核dna探針,因為隨機引物來自真核dna,其與真核序列的退火率要高於原核序列。因此,對於克隆的dan探針,常先將插入探針dna切下來回收後再標記,而缺口平移法可直接用於全質粒的標記。
5.聚合酶鏈反應(詳見第二十二章 )聚合酶鏈反應( polymerase chain reaction, pcr)是一種分子生物學新技術,由美國Cetus公司人類遺傳學部的kary. b. mullis於1985年創立。該技術利用兩個與相反鏈雜交並隨著於靶dna兩側的寡核苷酸引物經酶促合成特異的dna片段,包括模板變性,引物退火和引物延伸三個步驟的反覆循環,最終兩引物所夾靶dna得到千萬倍以上的擴增 。因此 ,pcr技術已成為一項極為有價值的技術並已迅速推廣套用。
pcr技術有許多重要用途,其中之一便是可用來標記高比活性dna探針。pcr技術具有很高的特異性,可在1~2h之內在量合成探針dna片段,如果在底物中加入[α-32p]dntp或其它標記的dntp,則探針dna合成過程中可得到很好的標記,標記物的摻入率可高達70%~80%。因此,pcr標記技術特別適用於大規模檢測和非放射性標記。該法的缺點是要合成一對特異性pcr引物。使用從探針dna上製備的小片段作引物也能取得較好的標記效果。
(二)核酸探針的非放射性標記技術
1.光敏生物素標記核酸目前使用的游標生物素試劑有兩種:光生物素(乙酸鹽)和補骨脂素生物素。它們都是由一個光敏基團、一個連線臂和一個生物素基團組成。光生物素的光敏基團是-n3,它在光作用下可與核酸中的鹼基結合。補骨脂素生物素中的光敏基團補骨脂素在光照(320~400μm)下,可與單鏈或雙鏈核酸發生反應,反應主要在t上,c上也有一定程度的反應。光敏生物素的連線臂含6~12個碳原子,用以減少探針雜交時的空間位阻。光敏生物素標記核酸,方法簡單,靈敏度也可達到pg水平,可用於外源基因的檢測。最近出現了一種新的光敏活性dna生物素試劑,即生物素-聚乙二醇-當歸素(bpa)。bpa的dna結合部分是一個活性糖香豆素衍生物,在長波uv下它可與dna鹼基共價鍵結合。bpa反應物與dna結合比光敏生物素更特異,在可見光下它不與核酸反應,這個特性可使bpa只標記粗製細胞裂解物中的核酸,而不標記蛋白、多糖和其他細胞大分子。
2.酶促生物素標記核酸以生物素化的脫氧核苷三磷酸(bio-11-dutp,bio –7 – datp、bio-11 -dctp)等代替相應32p標記的脫氧核苷三磷酸,經dna聚合酶作用摻入dna。bio-dutp代替dTTP,bio- datp代替datp, bio- dctp代替dctp。bio –11-dutp的11是指生物素基團與脫氧核苷酸之間連線臂的碳鏈長度。常用的酶促生物素標記dna的方法有缺口平移法和隨機引物延伸法。
3.寡核苷酸的生物素末端標記有5’-磷酸的化學標記法和3’-oh的酶促標記法。前者將寡核苷酸的5’-磷酸接上一個乙二胺,然後用琥珀醯亞胺生物素,將生物素基團連線在磷酸醯胺基上。後者是用末端轉移將bio-11 –dutp加於其3’-oh端(脫去一個焦磷酸)。
4.酶標 dna標記試劑是辣根過氧化酶(hrp)或鹼性磷酸酶(ap)。通過對苯醌(pbq)與聚乙烯亞胺(pei)連線而成(hrp-pbq-pei+),此試劑在戊二醛的作用下與變性的dna結合,使hrp與dna連線在一起,組成hrp標記的dna探針。
5.酶標寡核苷酸包括核苷酸5’末端標記hrp法和內部標記ap法。前者是在hrp中產生一個-hs反應基團,在寡核苷酸合成終了加在5’端,帶一個c6的-hs基,與活化的hrp反應生成5’-hrp寡核苷酸。後者是在全成寡核苷酸過程中將一個5’帶連線臂及cf3基團的尿苷3’亞磷醯亞胺合成在寡核苷酸鏈中,合成後此活化的寡核苷酸與ap反應即得到ap標記的寡核苷酸。
6.dna半抗原標記其原理與bio-11-dtup相同,只是用毛地黃甙代替生物素形成dig –11- dutp,酶促摻入dna分子。用抗毛地黃甙抗體檢測標記在dna上的半抗原分子digoxigenin(地高辛)
(三)非放射性探針的顯示體系
1.ap顯色體系
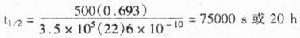 雜交分子
雜交分子bci –oh+nbt→紫色↓
aso:等位基因特異的寡核苷酸,BCIP:5溴-4氯-3吲哚磷酸,nbt:四氮唑藍,pi:磷酸。
2.hrp顯色體系
hrp + h2o2[hrp·h2o2]
oda –nh2 +[hrp · h2o2]棗→oda- n = oda/棕色↓+ hrp +h2o
oda:鄰-聯茴香胺。
3.abc顯色體系
dna –b + sa – ap→dna – b – sa或dna – b +sa - bap→dna –b –sa –bap
經上述兩反應,把ap連線在dna上以後,再進行ap酶顯色。這裡sa為streptavidin(鏈酶親合素),bap為生物素化的磷酸酶,b為生物素( biotin),abc為avidin – biotin - enzyme com-plex, 即親合素- 生物素-酶複合物。
以上反應ap亦可用hrp代替。
4.非放射發光自顯影若將ap或hrp的顯色底物根據光化學原理換成一種酶解後產生光子的化合物,可用自顯影技術暴光x線片顯示。
(1)hrp發光自顯影:氨基苯-甲醯肼在hrp與h2o2的作用下氧化為氨基苯二甲酸,同時放出n2及發光(波長428nm)。發光時加入某些酚的衍生物時可增強發光上千倍。反應如下圖:
(2)ap的發光自顯影:ap的發光底物是金剛烷二氧丁環磷酸鹽(AMPPD),它含有磷酸酯鍵在ap的作用下水解下一個磷酸,進而由分子內過氧鍵提供能源分解產生金剛酮和激發態的甲基間-氧苯甲酸陰離子,當此陰離子恢復到基態時發出光子。可用波拉黑白片(621型)直接暴光顯影。顯影信號強度比bcip/nbp顯色法強兩上數量級。是很前景的顯示體系。
其發光反應的原理如下:
hrp的發光原理:
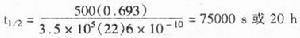 (圖)雜交分子
(圖)雜交分子ap的發光原理:
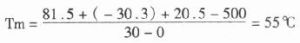 (圖)雜交分子
(圖)雜交分子核酸分子雜交的類型
隨著基因工程研究技術的迅猛發展,新的核酸分子雜交類型和方法在不斷湧現和完善。核酸分子雜交可按作用環境大致分為固相雜交和液相雜交兩種類型。固相雜交是將參加反應的一條核酸鏈先固定在固體支持物上,一條反應核酸游離在溶液中。固體支持物有硝酸纖維素濾膜、尼龍膜、乳膠顆粒、磁珠和微孔板等。液相雜交所參加反應的兩條核酸鏈都游離在溶液中。
由於固相雜交後,未雜交的游離片段可容易地漂洗除去,膜上留下的雜交物容易檢測和能防止靶dna自我復性等優點,故該法最為常用。常用的固相雜交類型有:菌落原位雜交、斑點雜交、狹縫雜交、southern印跡雜交、northern印跡雜交、組織原位雜交和夾心雜交等。
液相雜交是一種研究最早且操作複合的雜交類型,在過去的30年裡雖有時被套用,但總不如固相雜交那樣普遍。其主要原因是雜交後過量的未雜交探針在溶液中除去較為困難和誤差較高。近幾年由於雜交檢測技術的不斷改進,商業性基因探針診斷盒的實際套用,推動了液相雜交技術的迅速發展。下面對固相雜交和液相雜交分別進行介紹。
固相膜核酸分子雜交方法
固相核酸雜交多是在膜上進行,因此,以下主要介紹固相膜的核酸分子雜交方法:
1.dna的變性dna變性解鏈是雜交成功的關鍵。southern印跡雜交時dna在凝膠中變性,變性方法是將凝膠浸在數倍體積的1.5mol/l nacl和0.5mol/l naoh中1h然後用數倍體積的1mol/l tris –hcl(ph8.0)和1.5mol/l nacl溶液中和1h。dna受酸、鹼、熱等處理均能發生變性,但強酸會使核酸降解。一般認為鹼變性較好,可避免dna降解。熱變性在要低dna濃度(100μg/ml)和低鹽濃度(0.1mol/l ssc 含15mmol/l nacl - 1.5mmol/l檸檬酸三鈉,ph7.0)下進行。用ssc稀釋dna溶液為50μg/ml,加10mol/l naoh使最終濃度為0.1mol/l(ph約12.8),室溫變性10min,很快置冰鹽水中,用10min/l hcl或5mol/l nah2po4調ph到7~8[亦可用鹼變性後,調至中性,再加熱100。c 10min],dna變懷可用od260增加(約30%~40%)來檢測,變性dna醇沉澱呈雪樣,完全失去纖維狀沉澱。變性後加入等量冷的12×ssc,冰浴保存。
2.變性dna在硝酸纖維素膜上的固定硝酸纖維素濾膜(孔徑0.45μm)先在蒸餾水中充分浸泡,再用6×ssc浸泡30min~2h,涼乾。dna樣品轉移或加至硝酸纖維素膜上後,先室溫乾燥4h,然後在80。c真空乾燥2h。
3.預雜交濕潤的濾膜放入可加熱封口的塑膠袋中,按每平方厘米濾膜加0.2ml預熱至60。c的預雜交液(6×ssc,0.5%,sds,5×denhardt液,100μg/ml鮭魚精dna)。鮭魚精dna需經過剪下和dna酶消化處理,然後酒精沉澱純化,調濃度至10mg/ml,用前放100。c水浴中煮沸變性10min,冰水驟冷。儘可能將袋中氣泡趕盡,可封口器將袋口封住。將雜交袋浸入68。c水浴保溫3~12h。當預雜交液溫度升至68。c時,在濾膜表面常會形成小氣泡。輕輕晃動袋中液體即可除去這些小氣泡,這一點對於保證濾膜表面充分浸潤預雜交液很重要。
4.雜交從水浴中取出塑膠袋,用剪刀剪開一角,儘可能擠淨預雜交液。用吸管或大槍頭將雜交液加入袋中,用恰好是足量的液體保持濾膜濕潤(50μl/cm2)。溶液的組成是6×ssc,0.01mol/l edta, 變性的標記核酸探針,5×denhardt液,0.5% sds, 100μg/ml變性的鮭魚精dna。儘可能趕盡氣泡後,將塑膠袋嚴密封口,雜交反應在68℃水浴中進行,所需時間視探針和檢測靶dna的性質及探針的比活性等情況而定,一般4~20h。
5.洗膜取出塑膠袋,用剪刀剪開,小心取出濾膜,立即浸入盛有2×ssc和0.5% sds溶液的盤中,室溫下漂洗5min。再將濾膜移入2×ssc和0.1% sds溶液中,室溫下洗滌15min(輕輕搖動)。然後將濾膜移入0.1×ssc和0.5% sds溶液中;68℃輕輕搖動保溫2h,更換緩衝液後繼續保溫30min。
洗膜的溫度一般應控制在低於tm值12℃以上。(tm = 69.3 + 0.41x(g +c) %)。雙鏈dna的tm值隨錯配鹼基對數每增加1%而遞減1℃。
6.結果顯示非放射性檢測方法前已述及,此處主要介紹放射性測定方法。固相膜的放射性雜交結果顯示有兩種方式,一是放射性自顯影法,另一種是液閃計數法。前一種方法比較簡單,只需將雜交膜與x光片在暗盒中曝光數小時至數天,再顯影、定影即可。對於雜交信號較弱的固相膜,用一塊增感屏可顯著增強曝光強度。此外,為了減弱32p的散射,曝光通常在-20℃或-80℃下進行。液閃計數法主要用於打點和狹縫雜交及為了比較兩個雜交信號的強弱等情形。方法是將完成雜交的膜在漂洗結束後剪成小塊(每份樣品1塊),80℃真空乾燥後裝閃爍瓶。加入2~5ml閃爍液,剪2~3塊無樣品膜塊作為本底對照。在液體閃爍計數器上自動計數 。液體計數測定放射性強度也可在放射自顯影之後進行。
