研究概況
1905年,Bourquelot和Hérissey第一次從Aucuba japonica 的葉中發現了一個具有不穩定苷元的單糖苷一水化合物,命名為桃葉珊瑚苷,但因其不穩定而無法分離並確認結構。後來又相繼在Plantaginaceae (Bourdier,1907)、Garryaceae(Hérissey and Lebas,1910)、Scrophulariaceae (Braecke,1923a)、Oroban chaceae(Bridel,1929)、Globulariaceae (Zellner,1934)、Eucommiaceae (Plouvier,1944)等植物中發現了此化合物。直到1951年Hill和Van Heyningen才第一次從Aucuba japonica 的葉中、Melampyrum arvense和buddleia globosa中真正分離得到了這個化合物,並確定了分子式。
分布
 車前
車前生物合成
桃葉珊瑚苷屬於環戊烯型的環烯醚萜苷,此類化合物在植物體中是由焦磷酸牛兒醇磷酸酯經水解脫去焦磷酸後,經過氧化形成檸檬醛,後者經環合、雙鍵位移、水合和氧化,形成伊蟻二醛,然後伊蟻二醛經烯醇化後,發生
分子內縮合形成環烯醚萜醇,進而形成環烯醚萜苷。
桃葉珊瑚苷的主要來源為天然植物中提取,也有人運用細胞工程方法,在杜仲的愈傷組織培養出桃葉珊瑚苷。從經濟角度看,由於可供提取桃葉珊瑚苷的植物大多廉價易得,所以從植物中提取桃葉珊瑚苷比其他方法更具有研究開發前景。
結構與性質
桃葉珊瑚苷為白色粉末或結晶,
 高效液相色譜儀
高效液相色譜儀提取
桃葉珊瑚苷分子小,極性大,可以用水、乙醇、甲醇等極性溶劑進行提取,但是提取的時間、溫度、強光等對提取效率有明顯影響。彭密軍等用正交試驗法對杜仲中的桃葉珊瑚苷的提取工藝進行了優選,考察了提取時間、提取溫度、提取次數、提取溶劑乙醇含量以及料液比等因素對提取的影響,確定最佳提取參數為溫度70 ℃,時間0.5 h,提取次數3 次,提取溶劑為80 %的乙醇,料液比為1:9。有報導採用膠束電動毛細管色譜法分析比較多種提取方法從Veronica longifolia 葉中和車前屬植物中提取桃葉珊瑚苷的效率,結果表明用水做溶劑,加熱提取桃葉
 杜仲
杜仲由植物次生代謝途徑生成的有效成分的量都很少,從植物中大量提取與分離活性成分上有相當難度,而運用組織培養技術誘導次生代謝物含量高的愈傷組織,然後通過改變培養發酵條件(如溫度、光照及碳源等),套用次生代謝誘導子以及增加底物分子濃度等來改變目標產物產量的研究最近備受關注。曾黎瓊等對杜仲的葉片、莖段、子房、花葯等愈傷組織的培養物的有效成分進行了研究,發現樹皮、葉片和愈傷組織中都有含量不等的桃葉珊瑚苷。唐建軍等研究發現添加前體丙酮酸和次生代謝誘導子葡聚糖可顯著增加杜仲愈傷組織中桃葉珊瑚苷的產量。
含量測定
桃葉珊瑚苷是4-位無取代基環烯醚萜苷,含有多個極性官能團,性質活潑,極性較強,其含量測定方法主要有分光光度法、薄層掃描色譜法、HPLC法、毛細管電泳法等。桃葉珊瑚苷與硫酸銅、對二甲氨基苯甲醛等試劑反應生成有特定吸收波長的有色物質,因此可對其進行分光光度測定。彭密軍等採用均勻設計法對對二甲氨基苯甲醛顯色測定桃葉珊瑚苷的分光光度法進行了最佳化,研究了顯色劑用量、顯色時間、顯色溫度、酸用量等因素對桃葉珊瑚苷顯色反應的影響,發現20 %的鹽酸和濃硫酸催化效果均較好,吸光度相差不大,最佳反應條件是顯色劑用量為117 mL,顯色時間為22 min,顯色溫度為75 ℃,20 %鹽酸的用量為0.5 mL,冷卻時間為10 min,乙醇用量為215 mL,顯色產物在室溫下可穩定60 min,此方法靈敏度高,線性範圍為4.5~45 μg•mL-1,生成的有色物質的最大吸收波長為601 nm。 Krzek J.等利用高效薄層板對糖漿製劑中桃葉珊瑚苷進行了分離,以1,4-二甲基苯甲醛乙醇液:濃鹽酸(2:1) 為顯色劑,對桃葉珊瑚苷進行了薄層掃描法定量,掃描波長為580nm,此法的最低檢測限為0.046 µg•mL-1,回收率為91.14 %。用薄層掃描法同樣也被用於植物和兔眼房水中桃葉珊瑚苷及其代謝物的含量測定。桃葉珊瑚苷有孤立的兩個雙鍵,在206 – 210 nm處有較強吸收,利用HPLC法對桃葉珊瑚苷定量的報導較多。常用的色譜柱多為反相C18柱,流動相多為甲醇-水體系,如甲醇-水(17 :83),檢測波長多為204、206、210 nm。用HPLC測定時桃葉珊瑚苷的保留時間很短, 紫外檢測時甲醇、乙腈等均會產生一定干擾,孫文基等建
立了HPLC-蒸發光散射檢測(ELSD)法測定杜仲皮、杜仲葉和杜仲種子中桃葉珊瑚苷的含量,採用Inertsil ODS-3 C18色譜柱(4.6mm×250mm,5μm), 流動相為甲醇-水(8 : 92),流速1.0 mL•min-1,ELSD 氣化室溫度112.9 ℃,氣體流速2.8 L•min-1,線性範圍為1.04~20.9 μg,杜仲皮、杜仲葉和杜仲種子中桃葉珊瑚苷的含量分別為0.999 %,1.031 %,2.498 %。Cogne A.L.等採用HPLC-UV-MS和HPLC-NMR 研究了Jamesbrittenia fodina (Wild) O. M. Hilliard 的甲醇提取物中環烯醚萜類化合物的穩定性並對六種不穩定的AU衍生物進行了有效確證。膠束電動毛細管色譜法上近幾年發展起來的一種高效的分離手段,此法也可用於桃葉珊瑚苷的定量。Jurisic R.採用膠束電動色譜測定七種車前屬植物熱水提取物中的桃葉珊瑚苷,其含量從0.27 %到1.81 %不等。Suomi J.等採用膠束電動毛細管色譜-電噴霧離子化質譜聯用從Melitaea cinxia蝶成蟲及幼蟲體內分離並鑑定了包括桃葉珊瑚苷在內的6 種環烯醚萜苷,選取[M+Na]+,[M+Li]+ 和[M+NH4]+對桃葉珊瑚苷進行了定量,最低定量限為50 mg•L-1。合成與利用
楊小寶等從4-氫-5-羥基-3-亞甲基-5H-環戊二烯[2,1-c]吡啶以BH3•THF和H2O2 / NaOH處理,以57 %的收率得到了一對差向異構的二醇,再用過量新制的MnO2於室溫在CH2Cl2中攪拌20 h實現了苄位選擇性氧化,以52 %的收率得到了(±)-桃葉珊瑚素A[(±)-1],總產率為30 %,又以3-溴-4-pyridinecarboxaldehyde 為反應底屋用四步反應獲得了桃葉珊瑚素B,總產率為39 %。
由於桃葉珊瑚苷的特殊結構和顯著活性,可以其為起始物通過立體選擇性的反應合成多種化合物,甚至是活性更強的分子,當考慮環烯醚萜和其苷元作為手性前體化合物來合成環戊烷骨架的潛在套用時,桃葉珊瑚苷苷元就顯得更有價值了,其可以作為合成前列腺素和其他生物學活性的環戊烯化合物的手性天然前體物質,通過誘導桃葉珊瑚苷苷元的雙鍵移位(Δ7→Δ8)和阻止二醛結構的縮合來可實現杜仲醇(Eucommiol)的合成。用無水Na2CO3在苷元的乙酸乙酯或丙酮溶液中70 ℃溫孵24~48小時,苷元可轉化為手性分子Eucommial,在該水溶液中加入NaBH4,可定量的生成杜仲醇。杜仲醇和苷元的二醛形式在結構上非常類似,表明這些化合物在植物體內有一定的關係,此反應簡單且產率很高,對天然環戊醇化合物的合成具有極大意義。通過酶水解桃葉珊瑚苷再用NaBH4還原桃葉珊瑚苷苷元可以得到一個手性的環戊烯四醇-異杜仲醇(Isoeucommiol),一個新的合成甲基茉莉酮酸酯和前列腺素的中間體。再通過酸催化環化異杜仲醇,獲得了一個改良的前列腺素的前體化合物6,7-雙羥甲基-順-2-氧雜二環[3.3.0]辛-7-烯。Vokatsoa C.R.報導了用桃葉珊瑚苷合成了具有抗生素活性的氨基苷類似物——10,6'-二氨基-10,6'-二脫氧桃葉珊瑚苷和(6R)-6,10,6'-三氨基-6,10,6'-三脫氧桃葉珊瑚苷,AU的C-9和C-6’羥基在鹼性條件下可以被叔丁基二甲基氯矽烷選擇性烷基化,將甲矽烷基脫去後,以鄰苯二甲醯亞胺提供氮進行Mitsunobu反應,再用醋酐乙醯化後可得到上述兩個化合物。
生物活性
桃葉珊瑚苷的生物活性報導較多,但絕大部分是用桃葉珊瑚苷或桃葉珊瑚苷與β-葡萄糖苷酶作用形成含苷元的混合物來完成的,因而其生物活性研究均不夠深入和細緻,這是由於桃葉珊瑚苷苷元的不穩定性而導致其純品的製備和保存較為困難造成的。通常認為苷類藥物發揮藥效的主要是其苷元,糖的存在只是便於藥物的吸收。當桃葉珊瑚苷被β-葡萄糖苷酶水解後,藥理活性也相應改變。因此,對桃葉珊瑚苷苷元的研究將是桃葉珊瑚苷生物活性研究的重點。
1.植物抗生素
植物的次生代謝產物-環烯醚萜類成分是大自然賜給植物的“保護傘”,當植物遭遇病原菌或昆蟲的襲擊時,次生代謝產物會應激性的產生反應防禦“敵人”的“進攻”。多數車前科植物在接種病原性微生物後也能夠防禦性產生桃葉珊瑚苷和梓醇,Biere A.等人等研究了食草昆蟲Spodoptera exigua 和病原菌Diaporthe adunca對車前科植物 Plantago lanceolata 的作用,發現含桃葉珊瑚苷和梓醇多的植物的抗病蟲害能力明顯高於環烯醚萜類成分含量低的植物,這可能是因為被病原菌感染的植物產生了大量具有苦味的環烯醚萜類成分,是苦味而非毒性阻止了昆蟲的啃食。Marak H.B.等研究者也證明有些車前科植物可快速對Diaporthe adunca感染可作出反應,6 h後即可檢測到被誘導產生的桃葉珊瑚苷和梓醇,而且在8 天內沒有中斷,其中接種部位桃葉珊瑚苷和梓醇的水平最高,分別高出對照組的97 %和37 %,儘管這種被病原性微生物感染的植物從作為昆蟲的食品的角度上沒有任何質量的降低,甚至營養更加平衡了,但昆蟲卻不再啃食,這些提示我們在自然界桃葉珊瑚苷與病原體感染有密切聯繫,可以說環烯醚萜類成分是植物的“廣譜抗生素”它能增強植物對外界的防禦能力。
2.抗病毒作用
桃葉珊瑚苷對多種毒物引起的肝損傷具有保護作用。早在1978年,Chang I.M.等就發現了車前種子的提取物具有潛在的保肝活性,5年後人們證實正是桃葉珊瑚苷發揮了抗病毒、保護肝臟的作用。Yang K.H.等報導日本桃葉珊
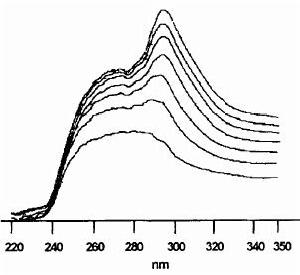 桃葉珊瑚苷苷元結合牛血清蛋白的紫外光譜圖
桃葉珊瑚苷苷元結合牛血清蛋白的紫外光譜圖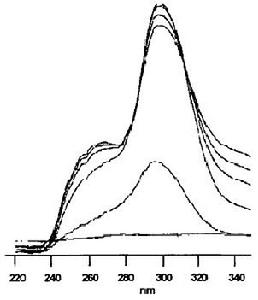 戊二醛結合牛血清蛋白的紫外光譜圖
戊二醛結合牛血清蛋白的紫外光譜圖3.抗炎作用
桃葉珊瑚苷具有明顯的抗炎活性,對於慢性變態反應炎症有顯著療效,能夠抑制12-O-十四烷醯佛波醋酸酯-13誘導的小鼠耳水腫,抑制率為72.0~80.0 %,對角叉菜膠誘導的小鼠後足水腫和苯醌誘導的扭體運動有顯著改善。Jeong H.J.研究發現桃葉珊瑚苷的抗炎作用與其對核轉錄因子NF-kB的特異性抑制有關。抗原刺激的肥大細胞能夠誘導腫瘤壞死因子-a(TNF-a)和白細胞介素- 6(IL-6)的合成,二者具有促炎症反應作用和免疫調節功能,其表達可被NF-kB調節,桃葉珊瑚苷能夠抑制抗原刺激的嗜鹼性白血球-2H3肥大細胞中NF-kB的p65亞基由細胞胞漿內向核內的移位,並通過阻止IkBa 的磷酸化和降解,使胞漿內IkBa 濃度升高,進而抑制NF-kB活性,而下調TNF -α和IL-6的合成與表達,其作用呈劑量依賴型,半數有效量分別為0.101 mg•mL-1和0.19 mg•mL-1,最大抑制率分別為73 ± 4.3 %和88.8 ± 5 %,這種抑制可能是一種特殊的作用機制,因為激活因子蛋白-1的結合活性並沒有被影響。NF-kB最初因其能促進編碼鼠B淋巴細胞免疫球蛋白的k輕鏈的基因轉錄而得名,是十分重要的核轉錄因子,能調節多種炎症和免疫基因的表達,與很多疾病特別是慢性炎症性疾病等密切相關,開發可抑制NFkB的藥物成為目前抗炎藥物研究的一個新動向,桃葉珊瑚苷可能為長期困擾人類的NF -κB相關疾病的治療提供新的思路。Bermejo B.P.等報導桃葉珊瑚苷對於鈣離子載體介導的小鼠腹膜巨噬細胞的白三烯C-4的釋放有明顯的抑制作用,半數有效量為72 mmol•L-1,還能夠抑制鈣離子載體介導的人血小板中血栓素B2的釋放,抑制率略低於布洛芬。Park K.S.等人對於桃葉珊瑚苷及桃葉珊瑚苷苷元抗炎活性的進一步研究表明,真正發揮作用的分子實際是桃葉珊瑚苷苷元,桃葉珊瑚苷苷元通過抑制RAW 264.7細胞中NF-kB活性進一步抑制TNF-a mRNA和蛋白質的生成,抑制作用呈劑量依賴性,半數有效量為9.2 mmol•mL-1,但並不影響其他細胞中cAMP的水平,Ling S.K.的研究也表明環烯醚萜苷經過β- 葡萄糖苷酶水解後獲得的苷元能夠抑制大豆脂肪氧化酶和牛睪丸透明質酸酶的活性,苷元的形成是環烯醚萜苷發揮生物活性的必要條件。
 微生物
微生物4.抗微生物活性
Ishiguro K.等人報導桃葉珊瑚苷在與β-葡萄糖苷酶共存時顯示抑制微生物的活性,但單獨存在時則沒有此作用,說明了桃葉珊瑚苷水解後的苷元是發揮抗菌活性的形式,其他多種由β-葡萄糖苷酶水解得到的環烯醚萜苷元也同樣具有抗菌活性,桃葉珊瑚苷苷元的抗菌活性很高,對於Staphylococcus aureus的最小抑菌濃度僅為6.25 ug•mL-1。
桃葉珊瑚苷具有抗氧化、抗光老化和促進膠原合成的功效,是一種潛在的純天然防衰老保護劑。氧自由基是機體代謝過程中不斷產生的損害自身的毒性物質,它能使細胞膜上的不飽和脂肪酸發生過氧化,破壞生物膜結構,並形成脂褐素。李發榮等採用分光光度法研究了桃葉珊瑚苷對Fenton反應和鄰苯三酚自氧化反應產生的自由基的清除作用,結果顯示桃葉珊瑚苷有較強的清除自由基作用,對組織勻漿、線粒體、微粒體的氧化損傷有較好的保護作用。Ho J.N. 研究表明桃葉珊瑚苷能預防紫外線引起的皮膚細胞光老化。紫外線B照射能使皮膚細胞內活性氧簇( reactive oxygen species,ROS)的產生增多,從而誘導基質金屬蛋白酶-1(MMP-1)的合成,引起皮膚的光老化,在人皮膚成纖維HS 68 細胞系經紫外線B照射後,桃葉珊瑚苷預處理組MMP-1的產生與對照組相比下降57 %,與老化相關的β-半乳糖苷酶的活性也同時被顯著降低,ROS和丙二醛的形成被抑制,而細胞的存活力與谷胱甘肽(GSH)水平均增加,桃葉珊瑚苷的抗氧化能力可能與這種抗光老化作用有一定關係。膠原蛋白是一種高分子蛋白質,它絲狀的膠原蛋白纖維能使肌膚結實而有彈性。隨著年齡增加,人體膠原蛋白會逐漸流失,肌膚逐漸失去彈性和光澤,出現色斑、皺紋等一系列老化現象。Li Y等人研究發現杜仲葉的熱水提取物、甲醇提取物和杜仲皮的甲醇提取物均可明顯提高假老齡模型大鼠的肉芽瘤的形成和膠原合成,給予50 mg•kg-1•d-1桃葉珊瑚苷組肉芽瘤的質量和膠原合成分別增加92 %和99 %,大鼠的體重、肝臟、腎臟、脾臟或胸腺質量均無影響;新鮮的杜仲皮中京尼平苷和桃葉珊瑚苷的含量很高,而新鮮杜仲皮的甲醇提取物對膠原合成的促進作用明顯強於乾燥後的皮,說明桃葉珊瑚苷和京尼平苷是促進膠原合成的主要有效成分,而膠原的新陳代謝正是與杜仲的修復細胞的功效密切相關的。氧化力被認為與糖尿病發展和併發症出現的有關。Lei J.的最新研究表明桃葉珊瑚苷對於鏈唑黴素誘導的糖尿病小鼠是一種抗氧化劑和胰腺保護劑。給予糖尿病小鼠桃葉珊瑚苷15 天后,小鼠的血糖降低了,脂質過氧化水平被升高了,肝和腎中的過氧化氫酶、GSH過氧化酶和超氧化物歧化酶的活性顯著降低,與糖尿病有關的損傷也有所逆轉。
6. 抗骨質疏鬆作用
 發生骨質疏鬆的骨骼
發生骨質疏鬆的骨骼 健康正常的骨骼
健康正常的骨骼7.神經營養作用
桃葉珊瑚苷的葡萄糖苷酶水解產物能夠引起特定的神經反應,在旁神經元PC 12 h細胞系培養中,其能誘導神經元軸突的生長分化,增強細胞對卡巴膽鹼和KCl介導的去極化,同時細胞胞漿內游離Ca2+濃度也被升高,其機制可能是桃葉珊瑚苷苷元激活了細胞內信號傳導通路中的某個成分,從而引起神經元細胞突觸產生新的分化。
8.抗腫瘤活性研究
多數環烯醚萜苷本身都沒有顯示抗腫瘤的活性,經酶解後才顯示出來抑制腫瘤的活性,而大多數的環烯醚萜苷元都具有抑制腫瘤的活性,說明環烯醚萜苷的不穩定苷元是發揮抗腫瘤活性的形式,而且具有半縮醛結構的苷元比不具有此結構的苷元顯示了更強的抗腫瘤活性。研究表明桃葉珊瑚苷對體外腫瘤細胞S-180的蛋白質的生物合成抑制輕微,桃葉珊瑚苷被β-葡萄糖苷酶水解生成的桃葉珊瑚苷苷元卻能夠顯著抑制蛋白質和RNA的生物合成,桃葉珊瑚苷苷元的抗腫瘤活性比一般含有半縮醛結構的苷元更高,這可能與C-6位上羥基的存在增強了活性有一定關係。大多數的抗腫瘤藥物都是作用於拓撲異構酶Ⅱ,而僅有很少的藥物能夠特異性的作用於拓撲異構酶Ⅰ,拓撲異構酶Ⅰ抑制劑通過穩定共價的DNA-拓撲異構酶裂解絡合物產生有毒DNA損傷,有的對癌症有治療作用,桃葉珊瑚苷既是很少見的拓撲異構酶Ⅰ抑制劑,它能夠穩定拓撲異構酶Ⅰ亞基與DNA鏈的共價結合,產生裂解絡合物中間體,但對於拓撲異構酶Ⅱ沒有作用,因此在作為癌症的化學保護劑和治療藥物上引起了人們的注意。
9.其他活性
除上述作用外,桃葉珊瑚苷還具有免疫調節作用、抗白血病、抗瘧原蟲、解痙等作用,桃葉珊瑚苷對於鈣誘導的子宮肌肉收縮有解痙作用,活性與罌粟鹼相似,可能與其能夠抑制鈣離子在細胞內外的活動有關,但不能抑制乙醯膽鹼誘導的離體豚鼠迴腸收縮。
毒性
急性毒性藥理實驗表明桃葉珊瑚苷幾乎是無毒的。
 動物實驗
動物實驗參考文獻
[1] Nina R , Edith G , Henrik F , Sǿren R.J, Carl E.O. Chemotaxonomy of Plantago. Iridoid glucosides and caffeoyl phenylethanoid glycosides [J] . Phytochemistry , 2000 , 55 (4) : 337-348.
[2] Taskova R.M., Gotfredsen C.H., Jensen S.R. Chemotaxonomy of Veroniceae and its allies in the Plantaginaceae [J] . Phytochemistry , 2006 , 67(3) : 286-301.
[3] Sǿren R.J., Dirk C.A., Takao O., Rene′e J.G. Veronica : Iridoids and cornoside as chemosystematic markers [J] . Biochemical Systematics and Ecology , 2005 , 33(10) : 1031 – 1047.
[4] Ramunno A., Serrilli A.M., Piccioni F., Serafini M., Ballero M . Taxonomical markers in two endemic plants of Sardinia : Verbascum conocarpum and Scrophularia trifoliate [J] . Nat. Prod. Res., 2006 , 20(5) : 511-516.
[5] Tamura Y., Nishibe S. Changes in the concentrations of bioactive compounds in plantain leaves. J. Agric [J] . Food Chem., 2002 , 50(9) : 2514 – 2518.
[6]彭密軍 , 周春山 , 鍾世安. 杜仲中桃葉珊瑚苷的提取工藝研究 [J] . 林產化學與工業,2003,23(3) : 65-68.
[7] 李發榮 , 楊建雄 , 李寶林 , 張尊聽 , 李偉. 太白參中桃葉珊瑚苷的分離鑑定和提取工藝研究 [J] . 中草藥 , 2003 , 34(9) : 802-803.
[8] 楊小梅 , 尚平平 , 候西鳳等.桃葉珊瑚苷的穩定性初步考察. 藥物分析雜誌 , 2003 , 23(3) : 167-169.
[9] Dong-Hyun Kim , Bok-Ryang Kim , Ji-Yeon Kim , et al. Mechanism of covalent adduct formation of aucubin to proteins [J] . Toxicol Lett , 2000 , 114 : 181-188.
[10] Suomi J., Siren H., Hartonen K., Riekkola M.L. Extraction of iridoid glycosides and their determination by micellar electrokinetic capillary chromatography [J] . Chromatogr. A , 2000 , 868 (1) : 73 – 83.
[11] Jurisic R. , Debeljak Z. , Vladimir-Knezevic S. , et al. Determination of aucubin and Catalpol in Plantago species by micellar electrokinetic chromatography. Z. Naturforsch , 2004 , 59 (1-2) : 27-31.
[12] 張永康 , 胡江宇 , 李輝等. 超臨界二氧化碳萃取杜仲果實中桃葉珊瑚苷工藝研究. 林產化學與工業 , 2006 , 26(4) : 113-116.
[13] 魏屹 , 宋良科 , 羅麗勤等. 超臨界CO2萃取峨眉桃葉珊瑚中桃葉珊瑚苷工藝條件研究 [J] . 現代中藥研究與實踐, 2007 , 21(4) : 52-55.
[14] 郭麗冰 , 楊超燕. 大孔吸附樹脂對桃葉珊瑚苷分離效果的研究 [J] . 中藥研究與信息 , 2005 , 7(9) : 21-23.
鑑定方法
分析方法 :HPLC-DADor/andHPLC-ELSD
鑑定方法:質譜(Mass),核磁(NMR)。

