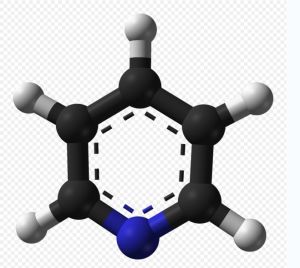
芳香性
吡啶的結構與苯非常相似,近代物理方法測得,吡啶分子中的碳碳鍵長為139pm,介於C-N單鍵(147pm)和C=N雙鍵(128pm)之間,而且其碳碳鍵與碳氮鍵的鍵長數值也相近,鍵角約為120°,這說明吡啶環上鍵的平均化程度較高,但沒有苯完全。吡啶環上的碳原子和氮原子均以sp2雜化軌道相互重疊形成σ鍵,構成一個平面六元環。每個原子上有一個p軌道垂直於環平面,每個p軌道中有一個電子,這些p軌道側面重疊形成一個封閉的大π鍵,π電子數目為6,符合4n+2規則,與苯環類似。因此,吡啶具有一定的芳香性。氮原子上還有一個sp2雜化軌道沒有參與成鍵,被一對孤對電子所占據,使吡啶具有鹼性。吡啶環上的氮原子的電負性較大,對環上電子云密度分布有很大影響,使π電子云向氮原子上偏移,在氮原子周圍電子云密度高,而環的其他部分電子云密度降低,尤其是鄰、對位上降低顯著。所以吡啶的芳香性比苯差。
在吡啶分子中,氮原子的作用類似於硝基苯的硝基,使其鄰、對位上的電子云密度比苯環降低,間位則與苯環相近,這樣,環上碳原子的電子云密度遠遠少於苯,因此象吡啶這類芳雜環又被稱為“缺π”雜環。這類雜環表現在化學性質上是親電取代反應變難,親核取代反應變易,氧化反應變難,還原反應變易。
研究歷史
拉姆齊,(1852年10月2日—1916年7月23日)英國化學家。1874~1880年,從事吡啶及其衍生物的研究,並於1877年合成了吡啶。
吡啶最先由比利時瑞利公司工業化生產,國際市場已有五十年以上的生產史,全球吡啶類化合物生產主要集中在美國、歐洲、日本和中國,約占全球吡啶類化合物總產量的80%以上。
物理性質
外觀與性狀
無色或微黃色液體,有惡臭。
熔點(℃):-41.6
沸點(℃):115.3
相對密度(水=1):0.9827
折射率:1.5067(25℃)
相對蒸氣密度(空氣=1):2.73
飽和蒸氣壓(kPa):1.33/13.2℃
閃點(℃):17
引燃溫度(℃):482
爆炸上限%(V/V):12.4
爆炸下限%(V/V):1.7
燃燒熱(定壓)(KJ/mol):2826.51
(定容)(KJ/mol):2782.97
比熱容(21℃,定壓)(KJ/kg.K):1.64
臨界溫度(℃):346.85
臨界壓力(MPa):6.18
電導率(25℃)(μS/cm):4
熱導率(20℃)(W/m.K):0.182
黏度(15℃)(mPa.S):1.038
(20℃)(mPa.S):0.952
(30℃)(mPa.S):0.829
蒸發熱(25℃)(KJ/mol):40.4277
熔化熱(KJ/mol):7.4133
生成熱(液體)(KJ/mol):99.9808
偶極距:2.22D吡啶為極性分子,其分子極性比其飽和的化合物——哌啶大。這是因為在哌啶環中,氮原子只有吸電子的誘導效應(-I),而在吡啶環中,氮原子既有吸電子的誘導效應,又有吸電子的共軛效應(-C)。
溶解性:溶於水和醇、醚等多數有機溶劑。吡啶與水能以任何比例互溶,同時又能溶解大多數極性及非極性的有機化合物,甚至可以溶解某些無機鹽類,所以吡啶是一個有廣泛套用價值的溶劑。吡啶分子具有高水溶性的原因除了分子具有較大的極性外,還因為吡啶氮原子上的未共用電子對可以與水形成氫鍵。吡啶結構中的烴基使它與有機分子有相當的親和力,所以可以溶解極性或非極性的有機化合物。而氮原子上的未共用電子對能與一些金屬離子如Ag、Ni、Cu等形成配合物,而致使它可以溶解無機鹽類。與水形成共沸混合物,沸點92~93℃。(工業上利用這個性質來純化吡啶。)
光譜性質
(1)吡啶的紅外光譜(IR):芳雜環化合物的紅外光譜與苯系化合物類似,在3070~3020cm-1處有C—H伸縮振動,在1600~1500cm-1有芳環的伸縮振動(骨架譜帶),在900~700cm-1處還有芳氫的面外彎曲振動。
(2)吡啶的核磁共振氫譜(HNMR):吡啶的氫核化學位移與苯環氫(δ7.27)相比處於低場,化學位移大於7.27,其中與雜原子相鄰碳上的氫的吸收峰更偏於低場。當雜環上連有供電子基團時,化學位移向高場移動,取代基為吸電性時,則化學位移向低場移動。
(3)吡啶的紫外吸收光譜(UV):吡啶有兩條紫外光譜吸收帶,一條在240~260nm(ε=2000),相應於π→π*躍遷(與苯相近)。另一條在270nm的區域,相應於n→π*躍遷(ε=450)。
化學性質
吡啶及其衍生物比苯穩定,其反應性與硝基苯類似。典型的芳香族親電取代反應發生在3、5位上,但反應性比苯低,一般不易發生硝化、鹵化、磺化等反應。吡啶是一個弱的三級胺,在乙醇溶液內,能與多種酸(如苦味酸或高氯酸等)形成不溶於水的鹽。工業上使用的吡啶,約含1%的2-甲基吡啶,因此可以利用成鹽性質的差別,把它和它的同系物分離。吡啶還能與多種金屬離子形成結晶形的絡合物。吡啶比苯容易還原,如在金屬鈉和乙醇的作用下還原成六氫吡啶(或稱哌啶)。吡啶與過氧化氫反應,易被氧化成N-氧化吡啶。鹼性和成鹽
吡啶氮原子上的未共用電子對可接受質子而顯鹼性。吡啶的共軛酸(N原子上接受一個質子後的吡啶)的pKa為5.25,比氨(pKa9.24)和脂肪胺(pKa10~11)都弱。原因是吡啶中氮原子上的未共用電子對處於sp2雜化軌道中,其s軌道成分較sp3雜化軌道多,離原子核近,電子受核的束縛較強,給出電子的傾向較小,因而與質子結合較難,鹼性較弱。但吡啶與芳胺(如苯胺,pKa4.6)相比,鹼性稍強一些。吡啶與強酸可以形成穩定的鹽,某些結晶型鹽可以用於分離、鑑定及精製工作中。吡啶的鹼性在許多化學反應中用於催化劑脫酸劑,由於吡啶在水中和有機溶劑中的良好溶解性,所以它的催化作用常常是一些無機鹼無法達到的。
吡啶不但可與強酸成鹽,還可以與路易斯酸成鹽。
此外,吡啶還具有叔胺的某些性質,可與鹵代烴反應生成季銨鹽,也可與醯鹵反應成鹽。
親電取代反應
吡啶是“缺π”雜環,環上電子云密度比苯低,因此其親電取代反應的活性也比苯低,與硝基苯相當。由於環上氮原子的鈍化作用,使親電取代反應的條件比較苛刻,且產率較低,取代基主要進入3(β)位。與苯相比,吡啶環親電取代反應變難,而且取代基主要進入3(β)位,可以通過中間體的相對穩定性來說明這一作用。
由於吸電性氮原子的存在,中間體正離子都不如苯取代的相應中間體穩定,所以,吡啶的親電取代反應比苯難。比較親電試劑進攻的位置可以看出,當進攻2(α)位和4(γ)位時,形成的中間體有一個共振極限式是正電荷在電負性較大的氮原子上,這種極限式極不穩定,而3(β)位取代的中間體沒有這個極不穩定的極限式存在,其中間體要比進攻2位和4位的中間體穩定。所以,3位的取代產物容易生成。
親核取代反應
由於吡啶環上氮原子的吸電子作用,環上碳原子的電子云密度降低,尤其在2位和4位上的電子云密度更低,因而環上的親核取代反應容易發生,取代反應主要發生在2位和4位上。吡啶與氨基鈉反應生成2-氨基吡啶的反應稱為齊齊巴賓(Chichibabin)反應,如果2位已經被占據,則反應發生4位,得到4-氨基吡啶,但產率低。如果在吡啶環的α位或γ位存在著較好的離去基團(如鹵素、硝基)時,則很容易發生親核取代反應。如吡啶可以與氨(或胺)、烷氧化物、水等較弱的親核試劑發生親核取代反應。
氧化還原反應
由於吡啶環上的電子云密度低,一般不易被氧化,尤其在酸性條件下,吡啶成鹽後氮原子上帶有正電荷,吸電子的誘導效應加強,使環上電子云密度更低,更增加了對氧化劑的穩定性。當吡啶環帶有側鏈時,則發生側鏈的氧化反應。吡啶在特殊氧化條件下可發生類似叔胺的氧化反應,生成N-氧化物。例如吡啶與過氧酸或過氧化氫作用時,可得到吡啶N-氧化物。
吡啶N-氧化物可以還原脫去氧。在吡啶N-氧化物中,氧原子上的未共用電子對可與芳香大π鍵發生供電子的p-π共軛作用,使環上電子云密度升高,其中α位和γ位增加顯著,使吡啶環親電取代反應容易發生。又由於生成吡啶N-氧化物後,氮原子上帶有正電荷,吸電子的誘導效應增加,使α位的電子云密度有所降低,因此,親電取代反應主要發生在4(γ)上。同時,吡啶N-氧化物也容易發生親核取代反應。
與氧化反應相反,吡啶環比苯環容易發生加氫還原反應,用催化加氫和化學試劑都可以還原。
吡啶的還原產物為六氫吡啶(哌啶),具有仲胺的性質,鹼性比吡啶強(pKa=11.2),沸點106℃。很多天然產物具有此環系,是常用的有機鹼。
結構
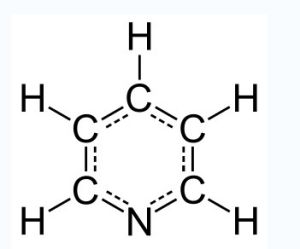 吡啶
吡啶從結構上看,吡啶是一種雜環化合物,是一個氮原子取代了苯上的一個碳原子而形成的化合物。氮原子的5個電子中,1個用來與其它碳原子形成大Π鍵,因此吡啶仍有芳香性。另外2個是定域的孤電子對,所以吡啶具有鹼性,也是一種良好的配體(作配體時記作py)。其共軛酸吡啶合氫離子的pKa值為5.30。
製備
吡啶可從天然煤焦油中獲得,也可由乙醛和氨製得。吡啶及其衍生物也可通過多種方法合成,其中套用最廣的是漢奇吡啶合成法,這是用兩分子的β-羰基化合物,如乙醯乙酸乙酯與一分子乙醛縮合,產物再與一分子的乙醯乙酸乙酯和氨縮合形成二氫吡啶化合物,然後用氧化劑(如亞硝酸)脫氫,再水解失羧即得吡啶衍生物。也可用乙炔、氨和甲醇在500℃通過催化劑製備。衍生物:吡啶的許多衍生物是重要的藥物,有些是維生素或酶的重要組成部分。吡啶的衍生物異煙肼是一種抗結核病藥,2-甲基-5-乙烯基吡啶是合成橡膠的原料。
3.將乙醛、甲醛和氨的混合物反應,製得吡啶。此外,1,5-戊二胺鹽酸鹽,經加熱環合,在鉑催化劑存在下脫氫也可製得吡啶。
套用途徑
除作溶劑外,吡啶在工業上還可用作變性劑、助染劑,以及合成一系列產品(包括藥品、消毒劑、染料、食品調味料、粘合劑、炸藥等)的起始物。吡啶還可以用做催化劑,但用量不可過多,否則影響產品質量。
用作緩蝕劑,吡啶對金屬起到緩蝕作用,利用其吸附作用達到緩蝕作用。
使用限量
FEMA(mg/kg):軟飲料1.0;嘴飲0.02~0.12;糖果和焙烤食品0.4。
應急處理
滅火方法
泄露應急處理
迅速撤離泄漏污染區人員至安全區,並進行隔離,嚴格限制出入。切斷火源。建議應急處理人員戴自給正壓式呼吸器,穿防毒服。儘可能切斷泄漏源。防止流入下水道、排洪溝等限制性空間。
小量泄漏:用砂土、乾燥石灰或蘇打灰混合。也可以用大量水沖洗,洗水稀釋後放入廢水系統。
大量泄漏:構築圍堤或挖坑收容。用泵轉移至槽車或專用收集器內,回收或運至廢物處理場所處置。
急救措施
1、皮膚接觸:脫去污染的衣著,用大量流動清水徹底沖洗。
2、眼睛接觸:立即提起眼瞼,用流動清水或生理鹽水沖洗至少15分鐘。
3、吸入:迅速脫離現場至空氣新鮮處。呼吸困難時給輸氧。呼吸及心跳停止時,立即進行人工呼吸和心臟按壓術。就醫。
4、食入:患者清醒時給飲足量溫水,催吐。就醫。
相關新聞
根據《中華人民共和國反傾銷條例》的規定,商務部將從2012年9月21日起對原產於日本和印度的進口吡啶傾銷、傾銷幅度及其對中國同類產品產業的損害、損害程度進行調查,並依法作出裁決。
根據公告,本次調查通常應在2013年9月21日前結束調查,特殊情況下可延長至2014年3月21日。
相關套用
處理含吡啶廢氣
 吡啶生產基地
吡啶生產基地1、本文的主要內容及取得的成果和結論如下:
套用低溫電漿對醫化行業中的惡臭氣體中代表性污染物——吡啶進行脫除試驗。採用自製高壓直流電源,在氧化氛圍中進行了脫臭試驗。實驗考察了峰值電壓、停留時間和初始濃度等工藝參數對去除率的影響。
結果表明:
(1)低溫電漿技術能有效處理含吡啶廢氣,去除率可達85%以上。
(2)提高峰值電壓可以提高處理效率,電壓提高到一定程度後,能檢測到臭氧產生,證實了羥基自由基的存在。
(3)增加停留時間可以提高處理效率,但從經濟角度考慮,停留時間選在7~10s左右較為適宜。
(4)在相同電壓下初始濃度越高去除效率越低,但絕對去除量增加,要達到一定的去除效率需要控制進氣濃度,使裝置達到最佳工作範圍,進氣濃度控制在400mg/m3或是一個合理的範圍,低溫等離子技術對中低濃度難以回收利用的含吡啶廢氣處理非常合適。
2、進行了低溫電漿處理醫化行業實際含吡啶廢氣工程試驗。
結果表明:(1)工程實際與實驗基本吻合,驗證了低溫電漿技術處理含吡啶廢氣的可行性。同時也證實了一定電壓下會有臭氧產生。
(2)在工藝設計條件下有足夠的羥基自由基等有效活性物產生,其降解吡啶的效率在90%以上,運行一年後效率未見明顯下降,且其處理的吡啶濃度在幾個到幾百mg/m3時均有良好效果。
(3)通過分析,推斷出吡啶在被降解過程中,經過一系列自由基反應過程最終轉化主要降解產物為二氧化碳、氮、二氧化氮和水。
3、進行了直流電暈電漿反應器技術經濟性評估,比較了低溫電漿技術、活性炭吸附技術、催化焚燒法、熱力焚燒技術的技術經濟指標,證明直流電暈電漿技術有很強的技術優越性。低溫電漿適合低濃度含吡啶惡臭廢氣的處理與套用。
合成及套用
螢光分子化學感測技術因具有分析快速、成本低、選擇性高、靈敏度高、不破壞樣品完整性等優點,已成為當前研究的熱點。螢光分子探針一般是由識別基團,螢光團,連線臂三部分構成。螢光分子探針的識別基團與客體結合後,其物化性質發生改變,這種變化以螢光團的光物理性質表達出來,如最大吸收波長遷移,螢光強度與量子產率發生變化等,從而實現對客體的識別。卟啉及其衍生物因具有較高的量子產率,摩爾吸光係數和大的Stokes位移,使其成為了一種很好的螢光團。
我們選用卟啉為螢光團,對Cd.Zn.Cu.Pb等金屬離子有很強的絡合作用的二(2-吡啶甲基)胺為識別團,設計併合成了六個螢光分子探針。首先,我們以2-氯甲基吡啶鹽酸鹽為原料,在十六烷基三甲基氯化銨的作用下先與苯胺反應形成二(2-吡啶甲基)苯胺,再通過Vilsmerier反應,在苯環上增加一個醛基,生成4-二(2-吡啶甲基)氨基苯甲醛,最後按照經典的Adler法合成得到5-{4-[二(2-吡啶甲基)氨基]苯基}-10,15,20-三苯基卟啉。
在合成方面,我們對部分探針分子的中間體的合成路線進行了改進。按照改進後的合成路線操作:5-(4-溴甲基)苯基-10,15,20-三苯基卟啉的分離提純難度降低了很多,而卟啉的反應總收率不發生變化;二(2-吡啶甲基)胺的收率提高至85%;N,N,N'-三(2-吡啶甲基)-1,2-乙二胺合成步驟由五步縮短為三步,大大降低了合成成本,反應總產率提高至41%。
與碘電荷轉移絡合物
本文以吡啶作為給體(D),以碘作為受體(A),用庚烷作為溶劑,套用紫外可見光譜法研究了吡啶與碘生成的電荷絡合物的光譜性質,以及碘蒸氣吸收峰發生“藍移”的性質。套用連續變化法驗證了吡啶與碘絡合物為1:1組成,進而利用Scott方程,用最小二乘法處理數據,獲得了精確的熱力學參數值(K,葉H,葉S,葉G)。
通過對絡合物熱力學參數的測量,我們能深入了解吡啶分子中氮原子的“鹼性”變化對碘分子的這種Lewis酸性的影響。文章針對隨著吡啶濃度的增加“藍移”波段位置及吸光度的變化進行了討論,隨著給體吡啶濃度增加,也即溶液極性增加,進而溶劑介電常數增加,媒質介電常數大量增加會使絡合物穩定性增加,所以波長達到極值不再變化;吸光強度增加可能是由於電荷轉移波段較高能級與可見碘波段較高能級混頻,那樣混頻使弱碘波段從強的電荷吸收波段獲得強度。文章還對電荷轉移波段和可見碘波段的“藍移”進行了理論分析。絡合物在催化合成、化學分析、水的軟化、醫藥工業,甚至在化學仿生學等方面,絡合物都起重大的作用,對其進行研究具有深遠的意義及廣闊的發展前景。
衍生物品
吡啶的許多衍生物是重要的藥物,有些是維生素或酶的重要組成部分。吡啶的衍生物異煙肼是一種抗結核病藥,2-甲基-5-乙烯基吡啶是合成橡膠的原料。健康危害
侵入途徑
吸入、食入、經皮吸收。健康危害
有強烈刺激性;能麻醉中樞神經系統。對眼及上呼吸道有刺激作用。高濃度吸入後,輕者有欣快或窒息感,繼之出現抑鬱、肌無力、嘔吐;重者意識喪失、大小便失禁、強直性痙攣、血壓下降。誤服可致死。慢性影響
長期吸入出現頭暈、頭痛、失眠、步態不穩及消化道功能紊亂。可發生肝腎損害。可引起皮炎。燃爆危險
本品易燃,具強刺激性。危險特性
其蒸氣與空氣可形成爆炸性混合物,遇明火、高熱極易燃燒爆炸。與氧化劑接觸猛烈反應。高溫時分解,釋出劇毒的氮氧化物氣體。與硫酸、硝酸、鉻酸、發煙硫酸、氯磺酸、順丁烯二酸酐、高氯酸銀等劇烈反應,有爆炸危險。流速過快,容易產生和積聚靜電。其蒸氣比空氣重,能在較低處擴散到相當遠的地方,遇火源會著火回燃。若遇高熱,容器內壓增大,有開裂和爆炸的危險。燃燒(分解)產物:一氧化碳、二氧化碳、氧化氮。毒理學資料
毒性
屬低毒類。中毒症狀
主要有噁心、疲勞、食慾缺乏,一些急性中毒事件中表現為精神崩潰。吡啶中毒引起死亡的事件比較少。急性毒性
LD501580mg/kg(大鼠經口);1121mg/kg(兔經皮);人吸入25mg/m³×20分鐘,對眼結膜和上呼吸道黏膜有刺激作用。毒性
大鼠吸入32.3mg/m³×7小時/日×5日/周×6月,肝重量係數增加;人吸入20~40mg/m³(長期);神衰、步態不穩、手指震顫、血壓偏低、多汗,個別肝腎有影響。影響
取代基對水溶解度的影響:當吡啶環上連有-OH、-NH2後,其衍生物的水溶度明顯降低。而且連有-OH、-NH2數目越多,水溶解度越小。其原因是吡啶環上的氮原子與羥基或氨基上的氫形成了氫鍵,阻礙了與水分子的締合。取代基對鹼性的影響:當吡啶環上連有供電基時,吡啶環的鹼性增加,連有吸電基時,則鹼性降低。與取代苯胺影響規律相似。
飲用水地表水源地的特定監測項目
| 對於生活飲用水地表水源地水質的監測是對水源地保護的一項基礎工作。我國的地表水環境標準中規定,除了要監測地表水環境質量標準基本項目外,還要監測80項特定監測項目。 |
| 三氯甲烷| 四氯化碳| 三溴甲烷| 二氯乙烷| 1,2-二氯乙烷| 環氧氯丙烷| 1,1-二氯乙烯| 1,2-二氯乙烯| 四氯乙烯| 氯丁二烯| 六氯丁二烯| 二甲苯| 異丙苯| 乙醛| 丙烯醛| 三氯乙醛| 1,2-二氯苯| 1,4二氯苯| 三氯苯| 四氯苯| 六氯苯| 硝基苯、二硝基苯 | 2,4-二硝基甲苯| 三硝基甲苯| 硝基氯苯| 2,4二硝基氯苯| 2,4-二氯苯酚| 2,4,6-三氯苯酚| 五氯苯酚| 苯胺| 聯苯胺| 丙烯醯胺| 水合肼| 四乙基鉛| 吡啶| 苦味酸| 丁基黃原酸| 活性氯| 滴滴涕| 環氧七氯| 對硫磷| 馬拉硫磷| 內吸磷 | 百菌清| 甲萘威| 溴氰菊酯| 阿特拉津| 苯並[A]芘| 甲基汞| 微囊藻毒素| 黃磷| 鉬| 硼| 鈦 |