理化數據
中文名稱:依達拉奉(依達拉豐、MC-971)
中文化學名:3-甲基-1-苯基-2-吡唑啉-5-酮
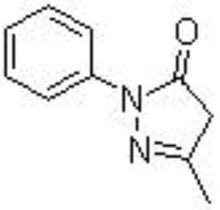 依達拉奉子圖
依達拉奉子圖原料藥生產廠家:濟南中科化工有限公司
英文化學名:3-methyl-1-phenyl-2-pyrazolin-5-one
分子量:174.19
CAS:89-25-8
用途:用於治療腦梗塞引起的神經病變。
質量標準:國家藥品標準
| 項目 | 企業標準 |
| 性狀 | 白色結晶性粉末 |
| 有關物質 | ≤1.0% |
| 乾燥失重 | ≤0.5% |
| 熾灼殘渣 | ≤0.1% |
| 重金屬 | ≤0.002% |
| 含量 | ≥98.5% |
包裝:5公斤/包,25公斤/桶。
【通用名】依達拉奉注射液
商品名
依達拉奉注射液(必存注射液)
英文名
Edaravone Injection
分子式
C10H10N2O 分子量:174.20
藥理作用
依達拉奉是一種腦保護劑(自由基清除劑)。臨床研究提示N-乙醯門冬氨酸(NAA)是特異性的存活神經細胞的標誌,腦梗塞發病初期含量急劇減少。腦梗塞急性期患者給予依達拉奉,可抑制梗塞周圍局部腦血流量的減少,使發病後第28天腦中NAA含量較甘油對照組明顯升高。臨床前研究提示,大鼠在缺血/缺血再灌注後靜脈給予依達拉奉,可阻止腦水腫和腦梗塞的進展,並緩解所伴隨的神經症狀,抑制遲發性神經元死亡。機理研究提示,依達拉奉可清除自由基,抑制脂質過氧化,從而抑制腦細胞、血管內皮細胞、神經細胞的氧化損傷。
毒理研究
遺傳毒性
依達拉奉Ames試驗,CHL染色體畸變試驗及小鼠微核試驗結果均為陰性。
生殖毒性
 依達拉奉
依達拉奉一般生殖毒性試驗中,大鼠給予依達拉奉3、20、200mg/kg,20、200mg/kg組的動物出現尿色橙褐、流淚、流涎和自主活動減少,體重和食量輕微下降;200mg/kg組雌鼠平均性周期延長,雌鼠、雄鼠生育力降低,胎仔胸腺殘留率升高。致畸敏感期毒性試驗中,妊娠大鼠靜脈給予依達拉奉3、30、300mg/kg,300mg/kg組母鼠攝食量下降,體重增加減緩,給藥後出現伏臥、步態不穩、自發運動減少、流淚等;各劑量組雄性胎仔體重及30mg/kg組雌性胎仔體重均低於對照組;各劑量組胎仔內臟畸形率升高,幼鼠耳廓展開、眼瞼開裂、睪丸下垂、陰道開口有延遲傾向。妊娠紐西蘭白兔靜脈注射給予依達拉奉3、20、100mg/kg,100mg/kg組動物出現尿液橙褐色、步態失調、流淚、瞳孔縮小、呼吸異常、後肢麻痹,給藥部位充血、水腫、壞死及炎症;3、100mg/kg組動物胎盤重量顯著增加。圍產期毒性試驗中,妊娠Wistar大鼠靜脈注射給予依達拉奉3、20、200mg/kg,200mg/kg組動物給藥期間攝食量下降,體重增加量降低,出現搖頭、眨眼、流淚、自發運動減少等症狀。幼鼠出生後28天曠場實驗結果顯示20、200mg/kg組幼鼠移動次數增高。
藥動學
據國外文獻報導:血藥濃度:健康成年男性受試者(5例)和65歲以上健康老年受試者(5例),以0.5mg/kg體重劑量,1日2次,每次30分鐘內靜脈滴注,連續給藥2天后,血漿中藥物濃度的變化和以起始給藥時的血漿藥物濃度變化所求得參數。
藥代參數
健康成年男性受試者(5例)健康老年受試者(5例)
Cmax(ng/ml) 888±171 1041±106
t1/2α(h) 0.27±0.11 0.17±0.03
t1/2β(h) 2.27±0.80 1.84±0.17
(平均值±標準差)
健康成年男性受試者和健康老年受試者兩者血漿中藥物濃度幾乎都同樣消失,沒有蓄積性。血清蛋白結合率體外試驗結果表明:依達拉奉的人血清蛋白和人血清白蛋白結合率分別為92%和89~91%。代謝在健康成年男性受試者和健康老年受試者中的研究結果表明:依達拉奉在血漿中的代謝物為硫酸絡合物、葡萄糖醛酸絡合物。在尿中主要代謝物為葡萄糖醛酸絡合物、硫酸絡合物。排泄健康成年男性受試者和健康老年受試者使用本品1日2次,每次0.5mg/kg,30分鐘內靜滴,連續2天給藥,每次給藥至12小時排泄尿液中含0.7~0.9%原藥,71.0~79.9%代謝物。
適應症
用於改善急性腦梗塞所致的神經症狀、日常生活活動能力和功能障礙。
相互作用
1、與先鋒唑啉鈉、鹽酸哌拉西林鈉、頭孢替安鈉等抗生素合用時,有致腎功能衰竭加重的可能,因此合併用藥時需進行多次腎功能檢測等觀察。
2、本品原則上必須用生理鹽水稀釋(與各種含有糖分的輸液混合時,可使依達拉奉的濃度降低)。
3、不可和高能量輸液、胺基酸製劑混合或由同一通道靜滴(混合後可致依達拉奉的濃度降低)。
5、勿與坎利酸鉀混合(產生混濁)。
不良反應
據日本臨床病例569例觀察,26例(4.57%)出現不良反應。主要表現為肝功能異常16次(2.81%),皮疹4次(0.70%)。569例中臨床檢測值異常變化的有122例(21.4%),主要是AST上升7.71%(43/558)、ALT上升8.23%(46/559)等肝功能檢測值異常。
嚴重不良反應
1、急性腎功能衰竭(程度不明)用藥過程中進行多次腎功能檢測並密切觀察,出現腎功能低下表現或少尿等症狀時,停止用藥並正確處理。
2、肝功能異常、黃疸(均程度不明)伴有AST、ALT、ALP、γ-GT、LDH上升等肝功能異常和黃疸,用藥過程中需檢測肝功能並密切觀察,出現異常情況,停止用藥並正確處理。
3、血小板減少(程度不明)有血小板減少表現,用藥過程中需密切觀察,出現異常情況,停止給藥並正確處理。
4、瀰漫性血管內凝血(DIC)(程度不明)可出現瀰漫性血管內凝血的表現,用藥過程中定期檢測。出現疑為瀰漫性血管內凝血的實驗室表現和臨床症狀時,停止給藥並進行正確處理。
其他不良反應
1、過敏症(0.1%~5%):主要表現為皮疹、潮紅、腫脹、皰疹、瘙癢感;
2、血細胞系統(0.1%~5%):主要表現為紅細胞減少,白細胞增多,白細胞減少,紅細胞壓積減少,血紅蛋白減少,血小板增多,血小板減少;
3、注射部位(0.1%~5%):主要表現為注射部位皮疹、紅腫等;
4、肝臟(發生率>5%):主要表現為AST升高,ALT升高,LDH升高,ALP升高,γ-GT升高。(發生率為0.1%~5%):總膽紅素升高,尿膽原陽性,膽紅素尿。
5、腎臟(0.1%~5%):主要表現為BUN升高,血清尿酸升高,血清尿酸下降,蛋白尿、血尿、肌酐升高(程度不明);
6、消化系統(0.1%~5%):噯氣
7、其他(0.1%~5%):發熱,熱感,血壓升高,血清膽固醇升高,血清膽固醇降低,甘油三酯升高,血清總蛋白減少,CK(CPK)升高,CK(CPK)降低,血清鉀下降,血清鈣下降。
禁忌
1、重度腎功能衰竭的患者(有致腎功能衰竭加重的可能)。
2、既往對本品有過敏史的患者。
注意事項
1、輕、中度腎功能損害的患者慎用(有致腎功能衰竭加重的可能)。
2、肝功能損害患者慎用(有致肝功能損害加重的可能)。
3、心臟疾病患者慎用(有致心臟病加重的可能,或可能伴見腎功能不全)。
4、高齡患者慎用(已有多例死亡病例的報導)。
因有加重急性腎功能不全或腎功能衰竭而致死的病例,因此在本品給藥過程中應進行多次腎功能檢測,同時在給藥結束後繼續密切觀察,出現腎功能下降的表現或少尿等症狀的情況下,立即停止給藥,進行適當處理。尤其是高齡患者,已有多例死亡病例的報告(大部分都在80歲以上),應特別注意。
孕婦用藥
1、孕婦或有妊娠可能的婦女禁用本品(尚不能確定關於妊娠期給藥的安全性)。
2、哺乳期的婦女禁用。必須套用時,在給予本藥期間應停止哺乳(動物實驗中有向乳汁中分布的報告)。
兒童用藥
兒童不應使用本品(因沒有使用經驗,尚不能確定兒童用藥的安全性)。
老年用藥
因老年生理機能低下,出現不良反應出現時應停止給藥並適當處理。一般而言,高齡患者(80歲以上)應慎用。
用法用量
一次30mg,每日兩次,加入適量生理鹽水中稀釋後靜脈滴注,30分鐘內滴完,一個療程為14天以內。儘可能在發病後24小時內開始給藥。
性狀
本品為無色或幾乎無色透明液體。
規格
注射液:10mg:5ml*1/支/支
注射液:30mg:20ml*1/支/支
注射液:20ml:30mg*1/支/支
注射液:10ml:15mg*1/支/支
注射液:5ml;10mg*1/瓶/瓶
注射液:20ml;30mg*1/瓶/瓶
注射液:10ml:60mg/支

