藥品名稱
通用名稱:依達拉奉注射液
商品名稱:必存
英文名稱:Edaravone Injection
漢語拼音:yidalafeng zhusheye
成份
本品主要成份為依達拉奉;
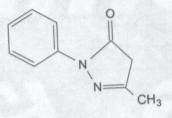
化學名稱:3-甲基-1-苯基-2-吡唑啉-5-酮(3-methyl-1-phenyl-2-pyrazolin-5-one)
化學結構式:
 必存
必存分子式:CHNO
分子量:174.20
輔料:丙二醇、焦亞硫酸鈉
性狀
本品為無色至微黃色(或微黃綠色)的澄明液體。
適應症
用於改善急性腦梗塞所致的神經症狀、日常生活活動能力和功能障礙。
新適應症進展
依達拉奉治療ALS(肌側索萎縮硬化症)的III期臨床研究已在日本、韓國完成,截至2015年12月,ALS作為新適應症進入日本、韓國依達拉奉說明書,同年美國FDA和歐洲藥品管理局分別批准依達拉奉位治療ALS的孤兒藥。
臨床套用進展
自2004年臨床使用以來,依達拉奉逐步成為國內卒中急性期治療的一線藥物,關於依達拉奉的臨床研究已逐步延伸至ALS、TIA、煙霧病,CEA(頸動脈內膜剝脫術)、CAS(頸動脈支架)、蛛網膜下腔出血、CO中毒、顱腦損傷、脊髓損傷、心梗、心臟手術等眾多臨床領域。
臨床套用循證醫學證據
臨床研究、指南及教科書中必存的相關內容:
依達拉奉III期臨床試驗(Eiichi Otomo,et al.Cerebrovasc Dis2003;15:222-229)依達拉奉可顯著改善急性缺血性卒中患者神經功能結局,因此依達拉奉可作為神經保護劑可用於治療急性缺血性卒中
依達拉奉治療急性腦卒中的Meta分析(liu m,et al.Dev Neurorehabil.2015;18(5):330-5):通過分析依達拉奉相關30項RCT(16項急性缺血性卒中的研究,14項腦出血的研究,涉及2857名參與者),表明依達拉奉可改善急性缺血性卒中和腦出血導致的神經功能損傷
2004、2009版《日本腦卒中治療指南》:依達拉奉在急性腦梗死的治療中有神經保護作用(B級推薦)
2012版日本《煙霧病(willis環自發性閉塞)診斷治療指南》神經保護劑依達拉奉可用於治療成人及兒童煙霧病導致的腦梗死
2007、2013版《美國急性缺血性卒中早期處理指南》:依達拉奉可改善急性缺血性卒中患者結局,其他神經保護劑無足夠的臨床數據支持它們在這方面的作用
2010、2014版《中國急性缺血性腦卒中診治指南》:依達拉奉是一種抗氧化劑和自由基清除劑,國內外多個隨機雙盲安慰劑對照試驗提示依達拉奉能改善急性腦梗死的功能結局病安全(II級推薦,B級證據)
2014版《中國腦出血診治指南》:依達拉奉在腦出血方面的臨床研究分析,對改善腦出血患者的神經功能缺失評分起到了積極的作用(II級推薦,C級證據)
2015版《臨床路徑治療藥物釋義》神經內科分冊腦出血篇、及神經外科分冊膠質瘤篇:若患者出現嚴重的神經功能缺損,應給予神經保護劑以保護腦細胞,提高對缺血缺氧的耐受性,如抗氧化劑和自由基清除劑依達拉奉等
人民衛生出版社《神經病學》;高等教育出版社《神經病學》:新型自由基清除劑依達拉奉可用於治療急性腦梗死
規格
(1)5ml:10mg;(2)20ml:30mg.
用法用量
一次30mg,每日2次,加入適量的生理鹽水中稀釋後靜脈滴注,30分鐘內滴完,一個療程為14天以內,儘可能在發病後24小時內開始給藥
藥物相互作用
1.先鋒唑啉鈉、鹽酸哌拉西林鈉、頭孢替安鈉等抗生素合用時,有致腎功能衰竭加重的可能,因此合併用藥時需進行多次腎功能檢測等觀察。
2.本品原則上必須用生理鹽水稀釋(與各種含有糖分的輸液混合時,可使依達拉奉的濃度降低)。
3.不可和高能量輸液、胺基酸製劑混合或由同一通道靜滴(混合後可致依達拉奉的濃度降低)。
4.勿與抗癲癇藥(地西泮、苯妥英鈉等)混合(產生混濁)。
5.勿與坎利酸鉀混合(產生混濁)。
藥代動力學
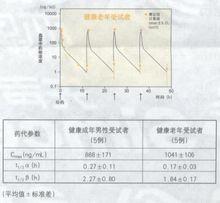
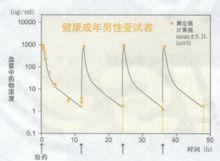
據國外文獻報導:血藥濃度健康成年男性受試者(5例)和65歲以上健康老年受試者(5例).以0.5mg/kg體重劑量,1日2次,每次30分鐘內靜脈滴注,連續給藥2天后,血漿中藥物濃度的變化和以起始給藥時的血漿藥物濃度變化所求得參數。如下圖、表所示:
 必存
必存1-1
 必存
必存1-2
健康成年男性受試者和健康老年受試者兩者血漿中藥物濃度幾乎都同樣消失,沒有蓄積性。
血清蛋白結合率,體外試驗結果表明:依達拉奉的人血清蛋白和人血清白蛋白結合率分別為92%和89-91%。
代謝,在健康成年男性受試者和健康老年受試者中的研究結果表明:依達拉奉在血漿中的代謝物為硫酸絡合物、葡萄糖醛酸絡合物。在尿中主要代謝物為葡萄糖醛酸絡合物、硫酸絡合物。
排泄,健康成年男性受試者和健康老年受試者使用本品1日2次,每欠0.5mg/kg,30分鐘內靜滴,連續2天給藥,每次給藥至12小時排泄尿液中含0.7—0.9%原藥,71.0—79.9%代謝物。
藥理毒理
藥理作用:
依達拉奉是一種腦保護劑(自由基清除劑)。臨床研究提示N-乙醯門冬氨酸(NAA)是特異性的存活神經細胞的標誌,腦梗塞發病初期含量急劇減少。腦梗塞急性期患者給予依達拉奉,可抑制梗塞周圍局部腦血流量的減少,使發病後第28天腦中NAA含量較甘油對照組明顯升高。
臨床前研究提示,大鼠在缺血/缺血再灌注後靜脈給予依達拉奉,可阻止腦水腫和腦梗塞的進展,並緩解所伴隨的神經症狀,抑制遲發性神經元死亡。機理研究提示,依達拉奉可清除自由基,抑制脂質過氧化,從而抑制腦細胞、血管內皮細胞、神經細胞的氧化損傷。
毒理研究:
遺傳毒性:
依達拉奉Ames試驗,CHL染色體畸變試驗及小鼠微核試驗結果均為陰性。生殖毒性:一般生殖毒性試驗中,大鼠給予依達拉奉3、20、200mg/kg。20、200mg/kg組的動物出現尿色橙褐、流淚、流涎和自主活動減少,體重和食量輕微下降;200mg/kg組雌鼠平均性周期延長,雌鼠、雄鼠生育力降低,胎仔胸腺殘留率升高。
致畸敏感期毒性試驗中,妊娠大鼠靜脈給予依達拉奉3、30、300mg/kg。300mg/kg組母鼠攝食量下降,體重增加減緩,給藥後出現伏臥、步態不穩、自發運動減少、流淚等;各劑量組雄性胎仔體重及30mg/kg組雌性胎仔體重均低於對照組;各劑量組胎仔內臟畸形率升高,幼鼠耳廓展開、眼瞼開裂、睪丸下垂、陰道開口有延遲傾向。妊娠紐西蘭白兔靜脈注射給予依達拉奉3、20、100mg/kg,100mg/kg組動物出現尿液橙褐色、步態失調、流淚、瞳孔縮小、呼吸異常、後肢麻痹,給藥部位充血、水腫、壞死及炎症;3、100mg/kg組動物胎盤重量顯著增加。圍產期毒性試驗中,妊娠Wistar大鼠靜脈注射給予依達拉奉3、20、200mg/kg。200mg/kg組動物給藥期間攝食量下降,體重增加量降低,出現搖頭、眨眼、流淚、自發運動減少等症狀。動鼠出生後28天曠場實驗結果顯示20、200mg/kg組幼鼠移動次數增高。
不良反應
據日本臨床病例569例觀察,26例(4.57%)出現不良反應。主要表現為肝功能異常16次(2.81%),皮疹4次(0.70%)。569例中臨床檢測值異常變化的有122例(21.4%),主要是AST上升7.71%(43/558)、ALT上升8.23%(46/559)等肝功能檢測值異常。
嚴重不良反應有:
1.急性腎功能衰竭(程度不明)用藥過程中進行多次腎功能檢測並密切觀察,出現腎功能低下表現或少尿等症狀時,停止用藥並正確處理。
2.肝功能異常、黃疸(均程度不明)伴有AST、ALT、ALP、γ-GTP、LDH上升等肝功能異常和黃疸,用藥過程中需檢測肝功能並密切觀察,出現異常情況,停止用藥並正確處理。
3.血小板藏少(程度不明)有血小板藏少表現,用藥過程中需密切觀察,出現異常情況,停止給藥並正確處理。
4.瀰漫性血管內凝血(DIC)(程度不明)可出現瀰漫性血管內凝血的表現,用藥過程中定期檢測,出現疑為瀰漫性血管內凝血的實驗室表現和臨床症狀時,停止給藥並進行正確處理。
其他不良反應(發生率)及主要表現為:
1.過敏症(0.1%-5%):主要表現為皮疹、潮紅、腫脹、皰疹、搔癢感;
2.血細胞系統(0.1%-5%):主要表現為紅細胞減少,白細胞增多,白細胞減少,紅細胞壓積值減少,血紅蛋白減少,血小板增加,血小板減少;
3.注射部位(0.1%-5%):主要表現為注射部位皮疹、紅腫;
4.肝臟(發生率>5%):主要表現為AST升高,ALT升高,LDH升高,ALP升高,γ-GTP升高;
肝臟(發生率為0.1%-5%):總膽紅素升高,尿膽原陽性,膽紅素尿;
5.腎臟(0.1%-5%):主要表現為BUN升高,血清尿酸升高,血清尿酸下降,蛋白尿、血尿、肌酐升高(程度不明);
6.消化系統(0.1%-5%):噯氣;
7.其他(0.1%-5%):發熱,熱感,血壓升高,血清膽固醇升高,血清膽固醇降低,甘油三酯升高,血清總蛋白減少,CK(CPK)升高.CK(CPK)降低,血清鉀下降,血清鈣下降。
貯藏
避光,在陰涼處(不超過20℃)保存。
包裝
(1)中硼矽玻璃安瓿,5ml,每盒6支。
(2)中硼矽玻璃安瓿,20ml,每盒6支;每盒4支。
有效期
24個月
執行標準
《中國藥典》2015年版二部
批准文號
(1)5ml,10mg:國藥準字H20031342
(2)20ml,30mg:國藥準字H20050280
生產企業
南京先聲東元製藥有限公司
核准日期
2016年8月10日