簡介
 硬水
硬水所謂“硬水”是指水中所溶的礦物質成分多,尤其是鈣和鎂。硬水並不對健康造成直接危害,但是會給生活帶來好多麻煩,比如用水器具上結水垢、肥皂和清潔劑的洗滌效率減低等。
硬水中含鹽量通常以硬度表示。硬度單位是度,1度相當於每升水中含10毫克的氧化鈣。硬度在8以上者通常稱為硬水,地下水(如井水、泉水)的含鹽量較多,屬於硬水。在硬水中,鈣鹽和鎂鹽以碳酸氫鹽、碳酸鹽、硫酸鹽、氯化物和硝酸鹽的形式存在。
硬度
水的硬度是指溶解在水中的鹽類物質的含量,即鈣鹽與鎂鹽含量的多少。含量多的硬度大,反之則小。GPG(grain per gallon)為水硬度單位, 1GPG表示1 加侖水中硬度離子( 鈣鎂離子) 含量為1 格令。PPM(Parts per million),百萬分之一,也作為硬度單位。1GPG=17.1PPM。
按美國WQA(水質量協會)標準,水的硬度分為6級:0~0.5GPG為軟水,0.5~3.5GPG為微硬,3.5~7.0GPG為中硬,7~10.5GPG為硬水,10.5~14.0GPG為很硬,14.0GPG以上為極硬。
形成
當水在大氣中凝聚時,它溶解了空氣中的二氧化碳,形成了叫做碳酸的弱酸。該酸最終隨雨落到地上,然後流過土壤上部到達岩石層,碳酸溶解了石灰(碳酸鈣和碳酸鎂),中和,並同時變硬。
當水流過土地和岩石時,它會溶解少量的礦物質成分,鈣和鎂就是其中最常見的兩種成分,也就是它們使水質變硬。水中含鈣、鎂等礦物質成分越多,水的硬度越大。
性質
 硬水標準
硬水標準水是一種很好的溶劑,能有效去除污物雜質。當水和二氧化碳結合生成微量的碳酸時,水的溶解效果更好。即便是在硬水質地區,只要水中的飽和指數未被超過,水管中就不會結水垢。若在飽和指數以下或正好在飽和的臨界點上,都不會有水垢生成。反之,軟水質中也會生水垢,如果超出了飽和指數的話。
飽和指數由水的酸鹼度決定。眾所周知,酸鹼度是通過PH測試來測定的:PH值越低,水中的酸性越強,飽和指數越高,所能溶解的礦物質成分也就越多;PH值越高,水中的鹼性越強,飽和指數越低,所能溶解的礦物質成分也就越少。
對水加熱、水壓降低(如打開水龍頭等)、在水中添加化學品劑等都會導致PH值升高。隨著PH值升高,水能溶解礦物質成分的能力減低,這些礦物質成分(碳酸鈣為主)也就沉澱出來,成了水垢。
循環系統(如冷卻塔、蒸汽鍋爐、循環水處理系統等)工作中,壓力和溫度長期處在變化中,造成水中PH值升高和過度飽和。
分類
硬度又分為暫時性硬度和永久性硬度。兩種硬度合稱為總硬度。
 硬水
硬水暫時性硬度
由於水中含有重碳酸鈣與重碳酸鎂而形成的硬度,經煮沸後可把硬度去掉,這種硬度稱為暫時性硬度,又叫碳酸鹽硬度。如果加石灰水(即氫氧化鈣,Ca(OH)2)進硬水,或者把硬水煮沸,硬度出現下降的話,這些下降了的硬度稱為“暫時硬度”。這些方法都會使鈣、鎂、碳酸氫鹽(HCO3− )等令水變硬的物質跑掉,或沉澱成固體物質。
煮沸方法:
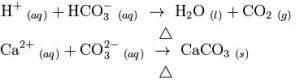 硬水
硬水其中,碳酸鈣(CaCO3)在水中的溶解度和溫度成反比,即是溶液越熱,就會有越多的碳酸鈣沉澱出來。
加石灰:
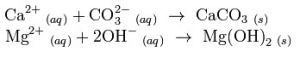 硬水
硬水永久硬度
由於含有鈣離子或者鎂離子的硫酸鹽或鹽酸鹽(氯化物)而產生的硬度,叫做永久硬度。水中含硫酸鈣和硫酸鎂等鹽類物質而形成的硬度,經煮沸後不能去除的硬度,稱為永久性硬度。這些硬度雖然不能用煮沸及加石灰方法來減低,但可以用其他方法,如離子交換(ionexchange)降低。硬度的改變
如果水流過石灰,硬度就會增加;而如果流過泥煤,硬度就會下降。水垢
由於肥皂或清潔劑分子帶有一個鈉離子,遇到硬水中的鈣、鎂離子時,會拋棄本身的鈉離子而與鈣、鎂離子結合,造成新的分子沒有清潔作用,轉而累積變成水垢,因此需要更多的肥皂或清潔劑才能達到清潔效果。優缺點
優點
硬水並不對健康造成直接危害。實際上,根據英國國家研究院(theNationalResearchCouncil)的研究,硬水質的飲用水富含人體所需礦物質成分,是人們補充鈣、鎂等成分的一種重要渠道。進一步的研究指出:當某一地區水中的礦物質溶量很高的時候,飲用水將成為人們吸收鈣等成分的主要來源:溶於水中的鈣是最易為人體吸收的。缺點
1.和肥皂反應時產生不溶性的沉澱,降低洗滌效果。(利用這點也可以區分硬水和軟水)2. 工業上,鈣鹽鎂鹽的沉澱會造成鍋垢,妨礙熱傳導,嚴重時還會導致鍋爐爆炸。由於硬水問題,工業上每年因設備、管線的維修和更換要耗資數千萬元。
3.硬水的飲用還會對人體健康與日常生活造成一定的影響。沒有經常飲硬水的人偶爾飲硬水,會造成腸胃功能紊亂,即所謂的“水土不服”;用硬水烹調魚肉、蔬菜,會因不易煮熟而破壞或降低食物的營養價值;用硬水泡茶會改變茶的色香味而降低其飲用價值;用硬水做豆腐不僅會使產量降低,而且影響豆腐的營養成分。 奶粉沖泡中的使用時,奶粉因為本身含有蛋白質和礦物等營養成分,加上高硬度的硬水的沖泡會加重對寶寶身體的負擔。嬰兒的內臟還未發育完全,礦物成分過量攝入可能會引起消化不良,所以礦物成分含量較低的軟水更適合沖泡奶粉。
生活影響
 硬水降低肥皂發泡
硬水降低肥皂發泡硬水常常給人們帶來許多危害。硬水在加熱的情況下,會沉澱出碳酸鈣和碳酸鎂,由於碳酸鈣、碳酸鎂不溶於水,所以對健康生活影響如下:
1、鏡面布滿水漬;
2、全棉衣服或毛巾板結僵硬,多次洗滌後顏色黯淡;
3、熱水器、增濕器等設備管路阻塞、流量減小、壽命縮短;
4、潔白的浴缸或座便器等設備泛黃;
5、龍頭、淋噴頭結滿水垢、滋生細菌、鍍鉻的表面水漬斑斑;
6、洗澡後皮膚乾燥、粗糙、發癢;
7、頭髮乾枯、打結,不易梳理,只能用專用洗髮膏;
8、水質發黃,有鐵鏽;
9、增加了腎膽結石發病幾率;
10、形成鍋垢,阻礙加熱器的傳熱,鍋垢太厚時,會使鍋爐局部過熱,引起鍋爐破裂而造成事故,有時還會引起鍋爐爆炸;
11、瀰漫著消毒水的難聞氣味;
12、指出的冰塊顏色混濁,有異味。
軟化處理
軟化原理
採用離子交換原理,將源水中的鈣,鎂離子置換出去,流出的水就是去掉了鈣鎂離子,硬度極低的軟化水。當離子樹脂吸收一定量的鈣鎂離子後就必須進行再生——用飽和的食鹽水浸樹脂層,把樹脂上的鈣鎂離子再置換出來,恢復樹脂的交換能力,並將廢液污水排出。
軟化方法
硬水經過處理後轉化為軟水的方法有以下幾種:
1.沉澱法
用石灰、純鹼處理,使水中Ca2+、Mg2+生成沉澱析出,過濾後即得軟水,其中的錳、鐵等離子也可除去。
 硬水軟化儀器
硬水軟化儀器(1)Na3PO4: 3CaSO4+2Na3PO4→Ca3(PO)4↓+3Na2SO4
(2)六偏磷酸鈉:Na4[Na2(P03)6]+Ca2+ →Na4[Ca(P03)6]+2Na+
(3)胺的醋酸衍生物(EDTA):與Ca2+、Fe2+、Cu2+等離子生成螯合物
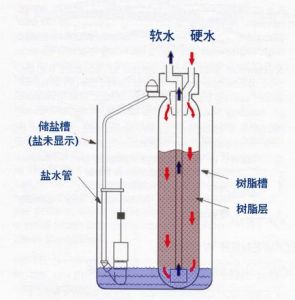
3.離子交換法
(1)原理:用無機or有機物組成一混合凝膠,形成交換劑核,四周包圍兩層不同電荷的雙電層,水通過後可發生離子交換。
陽離子交換劑:含H+ 、Na+ 固體與Ca2+ 、Mg2+ 離子交換
陰離子交換劑:含鹼性基因,能與水中陰離子交換
(2)常用交換劑:
a. 泡沸石:水化矽酸鈉鋁
Na2O·Z+Ca(HCO3)→CaO·Z+2NaHCO3
Na2O·Z+CaSO4→CaO·Z+Na2SO4
b. 磺化煤:
2Na(K)+CaSO4→Ca(K)2+NaSO4
2H(K)+CaSO4→Ca(K)2+naso4
c.離子交換樹脂
4.電滲析法
用直流電源作動力,使水中的離子選擇性地透過樹脂交換膜而獲得軟水。
 硬水
硬水5.煮沸法
該法只適用於暫時硬水。煮沸暫時硬水時的反應:
Ca(HCO3)2=CaCO3↓+H2O+CO2↑
Mg(HCO3)2=MgCO3↓+H2O+CO2↑
由於CaCO3不溶,MgCO3微溶,所以碳酸鎂在進一步加熱的條件下還可以與水反應生成更難溶的氫氧化鎂:
MgCO3+H2O=Mg(OH)2↓+CO2↑
由此可見水垢的主要成分為CaCO3和Mg(OH)2
6.石灰—純鹼法(工業用)
在這種方法中,暫時硬度加入石灰就可以完全消除,HCO3- 都被轉化成CO32- 。而鎂的永久硬度在石灰的作用下會轉化為等物質的量的鈣的硬度,最後被去除。反應過程中,鎂都是以氫氧化鎂的形式沉澱,而鈣都是以碳酸鈣的形式沉澱。
Ca2+(aq)--石灰-蘇打法-->CaCO3(s)
Mg2+(aq)--石灰-蘇打法-->Mg(OH)2(s)

