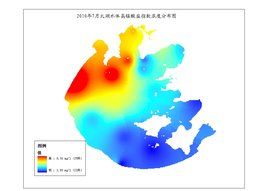
測定方法
一、試劑:
1.(1+3)硫酸
在三份體積的蒸餾水中,徐徐加入比重為1.84的濃硫酸l份。
 高錳酸鹽指數
高錳酸鹽指數2.草酸鈉溶液
(1)草酸鈉貯備液,C(1/2Na2C2O4)=0.1000 mg/L.
稱取在105一110℃烘乾l h並冷卻後的草酸鈉0.6705g溶於蒸餾水,移入100mL容量瓶中,用蒸餾水稀釋至標定刻度,搖勻待用。
(2)草酸鈉標準液,C(1/2Na2C2O4)=0.0100mol/L
吸取10.00mL上述草酸鈉貯備溶液移入100mL容量瓶中用蒸餾水稀釋至刻度。搖勻。
(3)高錳酸鉀溶液, C(1/5KMnO4)=0.01 mol/L
在台秤上稱取A.R高錳酸鉀0.64g,溶於2000mL蒸餾水中,加熱煮沸10—15min,冷卻靜置過夜(蓋上表面皿,以免塵埃入內)。用虹吸(或小心取出)取上層清液,轉入潔淨的棕色玻璃瓶中保存。用前需標定。
二、測定步驟
 高錳酸鹽指數
高錳酸鹽指數1.水樣測定
①取100mL混合水樣(如高錳酸鹽指數高於10mg/l,則酌情少取,並用水稀釋至100ml)於250mL錐形瓶中,
②加5mL(1+3)硫酸,混勻,
③用滴定管加入10.00mL,0.01mol/L高錳酸鉀溶液,搖勻,加數粒玻璃珠,在水浴上加熱煮沸30min(從水浴重新沸騰起計時),沸水浴液面要高於反應溶液的液面.
④取下錐形瓶,趁熱加入10.00mL的0.0100mol/L草酸鈉標準溶液,搖勻。立即用0.01mol/L高錳酸鉀溶液滴定至微紅色,記錄耗用的高錳酸鉀溶液的體積(V1)。要求回滴用的高錳酸鉀量在5mL左右,如滴定耗用體積大大或太小,應更改水樣取用量後重做。
 高錳酸鹽指數
高錳酸鹽指數2.高錳酸溶液校正係數(K)的測定
將上述已滴定完畢的溶液加熱到60-80℃,準確加入10.00mL的0.0100mol/L草酸鈉標準溶液,再用0.01mol/L高錳酸鉀溶液滴定至顯微紅色,記錄耗用的高錳酸鉀溶液體積(V)。按下式求得高錳酸鉀溶液的校正係數(K)
K=10.00/V
式中:
V......高錳酸鉀溶液消耗量(ml);
10.0.....加入草酸鈉標準溶液的體積,ml;
3.空白值測定
若水樣用蒸餾水稀釋時,則另取100mL蒸餾水,按水樣操作步驟進行空白試驗,記錄耗用的高錳酸鉀溶液的體積(V0)。
三、計算高錳酸鉀溶液
 高錳酸鹽指數
高錳酸鹽指數(1)水樣不經稀釋
高錳酸鹽指數(O2,mg/L)=[(10+V1)*K-10]*0.8
式中:
V1……回滴時高錳酸鉀的耗樣量(mL);
K……高錳酸鉀溶液的校正係數。;
8……氧(1/2O)的摩爾質量;
M......草酸鈉溶液濃度(mg/L)。
(2)水樣經稀釋
高錳酸鹽指數(O2,mg/L)
式中
V2……分取水樣量(mL)
Vo……空白試驗高錳酸鉀的消耗量(mL);
K……高錳酸鉀溶液的校正係數;
8……氧(1/2O)的摩爾質量;
R……稀釋水樣中蒸餾水的比值;例如:10.0ml水樣,加入90ml水稀釋至100ml,則R等於0.90。
四、注意事項
(1)在水浴中加熱完畢後,溶液仍應保持淡紅色,如變淺或全部褪去,應將水樣的稀釋倍數加大後再測定,使加熱氧化後殘留的高錳酸鉀為其加入量的1/2-1/3為宜。
(2)在酸性條件下,草酸鈉和高錳酸鉀反應的溫度應保持在60-80℃,所以滴定操作必須趁熱進行,若溶液溫度過低,需適當加熱。
高錳酸鹽[編輯]高錳酸根離子的結構。
高錳酸鹽是高錳酸所形成的鹽,含有四面體型的高錳酸根離子—MnO,其中錳的氧化態為+7,有強氧化性。高錳酸鉀是最重要的高錳酸鹽,為紫紅色的針狀晶體。
酸性溶液中,高錳酸根離子被還原為無色的Mn離子:
16+ 2 MnO+ 10Cl→ 2Mn+ 5+ 24 HO
6H+ 2 MnO+ 5 HCOOH → 8 HO + 2Mn+ 5
鹼性溶液中還原,既可得到棕色的(錳氧化態為+4),也可得到深綠色的(錳氧化態為+6)。
4OH+ 2 MnO+ 3CO→ 2+ 6+ 2 HO
3OH+ 2 MnO+HSO→ 2++ 2 HO
目錄
[隱藏]
1生產
2性質
3化合物
4參考資料
生產
高錳酸鹽可由錳化合物被強氧化劑氧化得到。可用的氧化劑如次氯酸鈉、二氧化鉛、高碘酸等:
2MnCl+ 5NaClO+ 6NaOH→ 2NaMnO+ 9 NaCl+ 3 HO
2MnSO+ 5PbO+ 3→ 2HMnO+ 5 PbSO+ 2 HO
錳酸鹽歧化也可得到高錳酸鹽:
3 NaMnO+ 2 HO → 2NaMnO++ 4 NaOH
工業上製取高錳酸鉀時,是用氯酸鉀作氧化劑與二氧化錳共熔,使其轉化為錳酸鉀,然後用氯氣氧化得到。
性質
高錳酸鹽類似於高氯酸鹽,性質較穩定,有很強的氧化性,常用在分析化學的氧化還原滴定中。它與還原性物質及有機物質混合可能發生燃燒或爆炸。加熱到230°C時,高錳酸鉀分解為錳酸鉀、二氧化錳和氧氣,這也是國中演示氧氣製備的常用反應之一:
2→++
高錳酸根離子不能和二價錳離子共存,是因為:
2MnO(aq) + 3Mn(aq) + 2HO ↔ 5MnO(S) + 4H
高錳酸鹽(尤其是高錳酸鉀)是有機合成中的氧化劑,它可以將胺氧化為相應的硝基化合物,將醇氧化為酮或醛和羧酸,將其他烯烴氧化為鄰二醇,以及將末端烯烴氧化為相應的羧酸等。烯烴被高錳酸鹽氧化的反應是通過一個環狀的高錳酸酯機理進行的,鹼性條件下的產物是二醇,酸性條件下則為兩個酮,如下圖所示。
化合物
主頁面::Category:高錳酸鹽
高錳酸鈣—Ca(MnO)
高錳酸鉀—KMnO
高錳酸鈉—NaMnO