歷史
 電解水
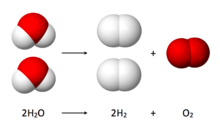
電解水反應方程式
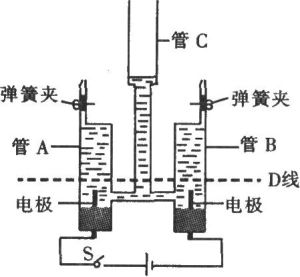
 電解水示意圖
電解水示意圖在100%法拉第效率(又稱”電流效率“)的情況下,即電能100%轉化成化學能,氫氣產生量為氧氣產生量的兩倍,且產生的氣體量與通過的電量成正比。但是,實際情況下,由於許多副反應的參與,法拉第效率會降低並產生一定量的副產物。
熱力學動力學
在標準大氣壓和溫度下,陽極上析氧反應的電極電勢為1.23V,陰極上析氫反應的電極電勢為0.00V,因此在一個大氣壓和25oC下,電解水所需要的理論最小電壓為1.23V。基於能斯特方程,電解水的理論電壓不受電解液的酸鹼度(pH)影響。雖然理論上熱力學決定的電解水最小電壓為1.23V,但是由於陰極和陽極反應都牽涉到多步電子轉移的過程,而每個電子轉移過程都會引入反應動力學能壘(活化能)。這些活化能的疊加會導致實際電解水的電壓遠大於1.23V,而這部分多施加的電壓被稱為過電勢。除了活化能之外,離子轉移率,電導性,表面氣泡的通暢性以及反應熵都會導致更大的過電勢。催化劑
催化劑通常能使電解水的活化能大大降低,從而降低電解水的過電勢。催化劑的優劣決定了電解水所需要的總電壓以及電能轉換為氫能的轉化效率。比如,兩根石墨電極組成的電解池通常需要大於2V的電壓才能產生氫氣和氧氣,因為石墨不是理想的催化劑,而兩片不鏽鋼電極組成的電解池需要大約1.6-1.8V的電壓就能產生氫氣和氧氣。研究新型的催化劑來增加能量轉換效率是能源領域十分受關注的焦點。在酸性環境中,鉑是析氫反應的催化劑,幾乎沒有任何過電勢以及非常小的塔菲爾斜率(電流增加10倍所需要的額外電壓),是幾乎理想化的催化劑,但是由於鉑貴金屬資源稀缺,科學家正在尋找一些廉價催化劑(過渡金屬硫化物,碳化物以及磷化物)。氧化銥是析氧反應的催化劑,但是同樣依賴於稀缺資源,同時由於高電位以及酸性環境,極少物質能能同時展現析氧反應催化活性和穩定性,所以目前為止還沒有找到氧化銥的替代品。
在鹼性環境中,鉑和氧化銥依然是很好的催化劑,但是由於氧化物和氫氧化物在鹼性環境的穩定性,能有更多低原子數過渡金屬化物的選擇。比如,鎳基合金展現出了優良的析氫反應的催化活性和穩定性,鎳鐵基複合材料和一些鈣鈦礦材料展現出了優良的析氧反應的催化活性。
工業套用前景
基於其高能量密度及零排放(不排放任何溫室效應氣體),氫氣已被列為潛在的清潔能源燃料,同時氫燃料可以通過氫燃料電池的方式驅動各類電子設備及電驅動車。隨著氫燃料的飛速發展,電解制氫也逐漸步入工業化取代傳統的蒸汽重整制氫的方法來消除對天然氣的依賴性同時又減少成本增加氫燃料純度。鹼性電解水制氫
現有的工業化電解制氫方法主要有兩種:鹼性電解水制氫,聚合物電解質電解水制氫。前者通常使用較廉價的電極材料,但工作電流較低,鎳鈷鐵複合材料作為陽極,鎳基材料作為陰極,高濃度的氫氧化鈉或氫氧化鉀溶液作為電解液,工作溫度為60-80度,工作電流為0.2-0.4A/cm2,氫氣產生量為<760Nm3/h。後者由於酸性環境通常使用貴金屬作為催化劑,但工作電流較高,氧化銥作為陽極,鉑作為陰極,工作溫度為50-80度,工作電流為0.6-2.0A/cm2,氫氣產生量大約為30Nm3/h。電解水工業化還處於發展階段,仍有許多問題需要處理。比如,通常電解槽需要高純度的淡水資源,直接用海水會導致電極腐蝕和效率降低,而電解海水的氯鹼工業需要更高的電壓來實現氫氣的製備,如何實現電解海水將極大地推動電解水工業化的步伐。

