克勞修斯,R.
正文
 德國物理學家,熱力學的奠基人之一。1822年1月2日生於普魯士的克斯林(今波蘭科沙林)的一個知識分子家庭,1840年入柏林大學,1847年在哈雷大學得主修數學和物理的哲學博士學位。1850年克勞修斯發表了著名論文《論熱的動力以及由此推出的關於熱學本身的諸定律》從而知名於學術界。1855年任蘇黎世工業大學教授,1867年返回德國任維爾茨堡大學教授,1869年起任波恩大學教授。1888年8月24日在波恩逝世。
德國物理學家,熱力學的奠基人之一。1822年1月2日生於普魯士的克斯林(今波蘭科沙林)的一個知識分子家庭,1840年入柏林大學,1847年在哈雷大學得主修數學和物理的哲學博士學位。1850年克勞修斯發表了著名論文《論熱的動力以及由此推出的關於熱學本身的諸定律》從而知名於學術界。1855年任蘇黎世工業大學教授,1867年返回德國任維爾茨堡大學教授,1869年起任波恩大學教授。1888年8月24日在波恩逝世。 在1850年的那篇論文中,克勞修斯首先從當時J.P.焦耳用實驗方法確立的熱功當量出發,提出一個基本定理:在一切只由熱產生功的情況,必有和所產生的功成正比的熱量被消耗掉;反之,消耗同樣數量的功也就會產生同樣數量的熱。接著他用理想氣體為例進行分析和討論,批判了熱質說的兩種錯誤的基本思想,即宇宙中的熱量是守恆的和物質內部的熱量是物質狀態函式。對傳統的關於潛熱和自由熱的概念,提出了自己的見解,認為:自由熱是決定物質溫度的因素,而且是組成物質的那些微粒的活力(動能),而潛熱則是已經轉化為內功的不再存在的熱。內功和分子的組態有關,從而是物質狀態函式;而外功卻和變化的過程有關。他並就理想氣體的情形寫出
dQ=dU+pdV
這個熱力學第一定律的表達式。
克勞修斯在這篇論文的第二部分,重新論證了S.卡諾在1824年的論斷──工作於兩個溫度間的一切理想熱機,有同樣多的熱量轉移而得到同樣多的功,且與工作物質無關,在這循環過程中熱量並未消失。熱量沒有消失顯然與熱的功當量矛盾,但卡諾論斷的第一部分仍然成立,否則就會導致在不發生任何其他變化的情況下,熱將從溫度低的物體轉移到溫度高的物體,而這是和熱的行為相矛盾的。這就是一般教科書中的熱力學第二定律的克勞修斯說法──熱不能自發地從低溫物體向高溫物體轉移──的來源。
在1854年發表的《力學的熱理論的第二定律的另一形式》一文中,他證明在一個可逆循環過程中
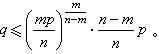
① 宇宙的能量是常數,
② 宇宙的熵趨於一最大值。後一結論就是所謂“熱寂說”的起源。
克勞修斯在氣體分子運動論的主要貢獻是:他解決了根據這個理論計算出的分子速度和氣體擴散現象所顯示的速度二者之間的矛盾,這在當時是大家都關心的一個有爭論的問題。他從分析氣體分子間的相互碰撞入手,引入在單位時間內所發生的碰撞數和分子的自由程兩個概念。雖然他在分析中假定了分子具有相同的速率,但他的這個工作開闢了研究氣體的輸運現象的道路。
