人物簡介
德國數學家魯道夫·尤利烏斯·埃馬努埃爾·克勞修斯(Rudolf Julius Emanuel Clausius, 1822年1月2日-1888年8月24日),德國物理學家和數學家,熱力學的主要奠基人之一。生於普魯士的克斯林(今波蘭科沙林),卒于波恩。他重新陳述了薩迪·卡諾的定律(又被稱為卡諾循環),把熱理論推至一個更真實更健全的基礎。他最重要的論文於1850年發表,該論文是關於熱的力學理論的,其中首次明確指出熱力學第二定律的基本概念。他還於1855年引進了熵的概念。
定義
描述在熱力學循環中,系統熱的變化及溫度之間的關係:
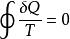 克勞修斯不等式
克勞修斯不等式其中δQ是系統熱的變化,吸熱為正,放熱為負。若是在可逆過程中,上式中的等號成立,其中小於符號則是對應不可逆過程。克勞修斯定理可用來定義狀態函式熵。
如果工作物質(即系統)的狀態是連續改變的,則可以認為它與一系列連續改變溫度的高溫熱源和低溫熱源進行熱量交換,且每次交換微量的熱量dQ,就可用下列積分形式:
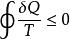 克勞修斯不等式
克勞修斯不等式這個公式稱克勞修斯不等式,其中取“=”時,即克勞修斯等式,取“<”號時即克勞修斯不等式。它是熱力學第二定律最普遍的數學表達式。
熱力學第二定律是熱力學最基本定律之一,敘述方法有多種,經典的提法有:(1) 1850年克勞修斯(Clausius)提出:熱不能自動地從低溫物體傳到高溫物體。(2) 1851年開爾文(Kelvin)提出:不可能從單一熱源吸熱使之全部變為功而沒有其它變化,也可表述為:第二類永動機是不能製成的。(1)、(2)兩種說法是等價的,可從其中任意一個推論出另一個。
性質
克勞修斯定理以數學的方式說明熱力學第二定律,魯道夫·克勞修斯提出此定理的目的在解釋系統中熱的流動及系統和環境的熵之間的關係,以定理可以解釋熵並提供其量化的定義。克勞修斯定理也提供了判斷一熱力學循環是否可逆的方法。
意義
此不等式表明:所有可逆 循環的克勞修斯積分值都等於零,所有不可逆循環的克勞修斯積分值都小於零。故本不等式可作為判斷一切任意循環是否可逆的依據。套用克勞修斯不等式還可推出如下的重要結論,即任何系統或工質經歷一個不可逆的絕熱過程之後,其熵 值必將有所增大。
歷史
克勞修斯定理是熱力學第二定律的數學解釋。也被稱為“克勞修斯不平等”,定理由魯道夫·克勞修斯(Rudolf Clausius)開發,旨在解釋系統中的熱流與系統及其周圍的熵之間的關係。克勞修斯在努力解釋熵並定量定義時發展了這一點。更直接地說,定理給了我們一種方法來確定循環過程是可逆的還是不可逆的。克勞修斯定理為理解第二定律提供了一個定量公式。
克勞修斯是第一個處理熵思想的人,甚至負責給這個名字。現在所謂的克勞修斯定理是在1862年首次在克勞修斯第六回憶錄“關於轉換等同於內部工作的定理的套用”中出版的。克勞修斯試圖通過加熱(δQ)到系統中顯示熵與能量流之間的比例關係。在一個系統中,這種熱能可以轉化為工作,工作可以通過循環過程轉化為熱量。克勞修斯寫道:“周期性過程中發生的所有變換的代數和只能小於零,或者作為一個極端的情況,等於0。
克勞修斯是最早研究熵的科學家之一,而且為此物理量命名。少為人知的是克勞修斯定理最早是發表於他在1862年的第六份調查報告《On the Application of the Theorem of the Equivalence of Transformations to Interior Work》。克勞修斯想要找到熵和系統中熱量流動(dQ)之間的比例關係。在一熱力學循環中,系統的熱可以轉換為功,而功也可以轉換為熱。克勞修斯認為“熱力學循環中所有轉換的代數和只能是正值,在一些特殊的情形下會是零。”轉言之,對於所有循環且可逆的過程,下式恆成立:
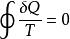 克勞修斯不等式
克勞修斯不等式