簡介
克勞修斯定理(英語: Clausius theorem)也稱為 克勞修斯不等式(英語: Clausius Inequality),全稱克勞修斯積分不等式。是德國科學家魯道夫·克勞修斯在1855年提出的熱力學不等式,描述在熱力學循環中,系統熱的變化及溫度之間的關係:
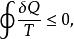 克勞修斯定理
克勞修斯定理其中,δQ是系統熱的變化,吸熱為正,放熱為負。若是在可逆過程中,上式中的等號成立,其中小於符號則是對應不可逆過程。克勞修斯定理可用來定義狀態函式熵。
定義
如果系統的狀態是連續改變的,則可認為它與一系列連續改變溫度的高溫熱源和低溫熱源進行熱量交換,且每次交換微量的熱量dQ,就可用下列積分形式表示:
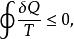 克勞修斯定理
克勞修斯定理這個公式稱克勞修斯不等式,其中取“=”時,即克勞修斯等式,取“<”號時即克勞修斯不等式,它是熱力學第二定律最普遍的數學表達式。熱力學第二定律是熱力學最基本定律之一,敘述方法有很多種,經典的提法有:(1) 1850年克勞修斯(Clausius)提出:熱不能自動地從低溫物體傳到高溫物體。(2) 1851年開爾文(Kelvin)提出:不可能從單一熱源吸熱使之全部變為功而沒有其它變化,也可表示為:第二類永動機是不能製成的。(1)、(2)兩種說法是等價的,可從其中任意一個推論出另一個。
性質
此不等式表明:所有可逆循環的克勞修斯積分值都等於零,所有不可逆循環的克勞修斯積分值都小於零。故本不等式可作為判斷一熱力學循環是否可逆的方法。 克勞修斯定理以數學的方式說明熱力學第二定律,魯道夫·克勞修斯提出此定理的目的在解釋系統中熱的流動及系統和環境的熵之間的關係,以定理可以解釋熵並提供其量化的定義,還可推出另一個重要結論,即任何系統經歷一個不可逆的絕熱過程之後,其熵值必將有所增大。

