表述
克勞修斯表述
不可能把熱量從低溫物體傳向高溫物體而不引起其它變化。
英國物理學家開爾文(原名湯姆遜)在研究卡諾和焦耳的工作時,發現了某種不和諧:按照能量守恆定律,熱和功應該是等價的,可是按照卡諾的理論,熱和功並不是完全相同的,因為功可以完全變成熱而不需要任何條件,而熱產生功卻必須伴隨有熱向冷的耗散。他在1849年的一篇論文中說:"熱的理論需要進行認真改革,必須尋找新的實驗事實。"同時代的克勞修斯也認真研究了這些問題,他敏銳地看到不和諧存在於卡諾理論的內部。他指出卡諾理論中關於熱產生功必須伴隨著熱向冷的傳遞的結論是正確的,而熱的量(即熱質)不發生變化則是不對的。克勞修斯在1850年發表的論文中提出,在熱的理論中,除了能量守恆定律以外,還必須補充另外一條基本定律:"沒有某種動力的消耗或其他變化,不可能使熱從低溫轉移到高溫。"這條定律後來被稱作熱力學第二定律。
開爾文表述
不可能製成一種循環動作的熱機,從單一熱源取熱,使之完全變為功而不引起其它變化。
這是從能量消耗的角度說的。開爾文表述還可以表述成:第二類永動機不可能實現。
開爾文的表述更直接指出了第二類永動機的不可能性。所謂第二類永動機,是指某些人提出的例如製造一種從海水吸取熱量,利用這些熱量做功的機器。這種想法,並不違背能量守恆定律,因為它消耗海水的內能。大海是如此廣闊,整個海水的溫度只要降低一點點,釋放出的熱量就是天文數字,對於人類來說,海水是取之不盡、用之不竭的能量源泉,因此這類構想中的機器被稱為第二類永動機。而從海水吸收熱量做功,就是從單一熱源吸取熱量使之完全變成有用功並且不產生其他影響,開爾文的說法指出了這是不可能實現的,也就是第二類永動機是不可能實現的。
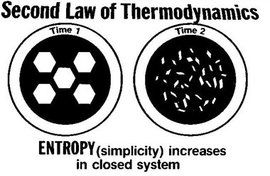
熵增加原理
見:熵增加原理
孤立系統的熵永不自動減少,熵在可逆過程中不變,在不可逆過程中增加。
熵增加原理是熱力學第二定律的又一種表述,它比開爾文、克勞修斯表述更為概括地指出了不可逆過程的進行方向;同時,更深刻地指出了熱力學第二定律是大量分子無規則運動所具有的統計規律,因此只適用於大量分子構成的系統,不適用於單個分子或少量分子構成的系統。
定律的其他表述
除上述幾種表述外,熱力學第二定律還有其他表述。 如針對焦耳熱功當量實驗的普朗克表述:
"不可存在一個機器,在循環動作中把以重物升高而同時使一熱庫冷卻。"
以及較為近期的黑首保勞-肯南表述(Hatsopoulos-Keenan statement):
"對於一個有給定能量,物質組成,參數的系統,存在這樣一個穩定的平衡態:其他狀態總可以通過可逆過程達到之。"
可以論證,這些表述與克勞修斯表述以及開爾文表述是等價的。
熱力學第二定律說明:熱量可以自發地從較熱的物體傳遞到較冷的物體,但不可能自發地從較冷的物體傳遞到較熱的物體(克勞修斯表述);也可表述為:兩物體相互摩擦的結果使功轉變為熱,但卻不可能將這摩擦熱重新轉變為功而不產生其他影響。對於擴散、滲透、混合、燃燒、電熱和磁滯等熱力過程,雖然其逆過程仍符合熱力學第一定律,但卻不能自發地發生。熱力學第一定律未解決能量轉換過程中的方向、條件和限度問題,這恰恰是由熱力學第二定律所規定的。
定律解釋
形成
①熱力學第二定律是熱力學的基本定律之一,是指熱永遠都只能由熱處轉到冷處(在自然狀態下)。它是關於在有限空間和時間內,一切和熱運動有關的物理、化學過程具有不可逆性的經驗總結。
上述(1)中①的講法是德國科學家克勞修斯(Clausius)在1850年提出的。②的講法是開爾文於1851年提出的。這些表述都是等效的。
在①的講法中,指出了在自然條件下熱量只能從高溫物體向低溫物體轉移,而不能由低溫物體自動向高溫物體轉移,也就是說在自然條件下,這個轉變過程是不可逆的。要使熱傳遞方向倒轉過來,只有靠消耗功來實現。
在②的講法中指出,自然界中任何形式的能都會很容易地變成熱,而反過來熱卻不能在不產生其他影響的條件下完全變成其他形式的能,從而說明了這種轉變在自然條件下也是不可逆的。熱機能連續不斷地將熱變為機械功,一定伴隨有熱量的損失。第二定律和第一定律不同,第一定律否定了創造能量和消滅能量的可能性,第二定律闡明了過程進行的方向性,否定了以特殊方式利用能量的可能性。
②人們曾構想製造一種能從單一熱源取熱,使之完全變為有用功而不產生其他影響的機器,這種空想出來的熱機叫第二類永動機。它並不違反熱力學第一定律,但卻違反熱力學第二定律。有人曾計算過,地球表面有10億立方千米的海水,以海水作單一熱源,若把海水的溫度哪怕只降低0。25度,放出熱量,將能變成一千萬億度的電能足夠全世界使用一千年。但只用海洋做為單一熱源的熱機是違反上述第二種講法的,因此要想製造出熱效率為百分之百的熱機是絕對不可能的。
③從分子運動論的觀點看,作功是大量分子的有規則運動,而熱運動則是大量分子的無規則運動。顯然無規則運動要變為有規則運動的幾率極小,而有規則的運動變成無規則運動的幾率大。一個不受外界影響的孤立系統,其內部自發的過程總是由幾率小的狀態向幾率大的狀態進行,從此可見熱是不可能自發地變成功的。
④熱力學第二定律只能適用於由很大數目分子所構成的系統及有限範圍內的巨觀過程。而不適用於少量的微觀體系,也不能把它推廣到無限的宇宙。
⑤根據熱力學第零定律,確定了態函式——溫度;
根據熱力學第一定律,確定了態函式——內能和焓;
根據熱力學第二定律,也可以確定一個新的態函式——熵。可以用熵來對第二定律作定量的表述。
過程
第二定律指出在自然界中任何的過程都不可能自動地復原,要使系統從終態回到初態必需藉助外界的作用,由此可見,熱力學系統所進行的不可逆過程的初態和終態之間有著重大的差異,這種差異決定了過程的方向,人們就用態函式熵來描述這個差異,從理論上可以進一步證明:
可逆絕熱過程Sf=Si,
不可逆絕熱過程Sf>Si,
式中Sf和Si分別為系統的最終和最初的熵。
也就是說,在孤立系統內對可逆過程,系統的熵總保持不變;對不可逆過程,系統的熵總是增加的。這個規律叫做熵增加原理。這也是熱力學第二定律的又一種表述。熵的增加表示系統從幾率小的狀態向幾率大的狀態演變,也就是從比較有規則、有秩序的狀態向更無規則,更無秩序的狀態演變。熵體現了系統的統計性質。
條件
第二定律在有限的巨觀系統中也要保證如下條件:
1.該系統是線性的;
2.該系統全部是各向同性的。
另外有部分推論:比如熱輻射:恆溫黑體腔內任意位置及任意波長的輻射強度都相同,且在加入任意光學性質的物體時,腔內任意位置及任意波長的輻射強度都不變。
質疑
通過熱泵,溫差電池和熱交換器實現永動機
管束式熱交換器的管束由溫差材料構成,管束做成溫差電池。這樣的裝置可以使流體熱交換的同時發電。熱交換器的效率還是原來的效率,溫差發電的效率有了極大的提高。在理論上管束式熱交換器的熱交換效率可以達到100%所以這樣的裝置的熱電轉換效率理論上是100%。這時候由熱泵提從環境中抽取熱量供給溫差電池式熱交換器,溫差電池式熱交換器就會將熱泵提供的熱量完全轉化為電能。因為熱泵提供的熱量大於熱泵消耗的電量所以溫差電池出的電量大於熱泵消耗的電量。這樣就實現第二類永動機。麥克斯韋妖
麥克斯韋妖是詹姆斯·麥克斯韋假想存在的一理想模型。麥克斯韋構想了一個容器被分為裝有相同溫度的同種氣體的兩部分A、B。麥克斯韋妖看守兩部分間"暗門",可以觀察分子運動速度,並使分子運動較快的分子向確定的一部分流動,而較慢的分子向另一部分流動。經過充分長的時間,兩部分分子運動的平均速度即溫度(參考統計力學中對於溫度的微觀解釋)產生差值並越來越大。經過運算可以得到這一過程是熵減過程,而麥克斯韋妖的存在使這一過程成為自發過程,這是明顯有悖於熱力學第二定律的。
對其最為有名的回應之一是由列奧·西拉德於1929年提出。西拉德指出如果麥克斯韋妖真正存在,那么它觀察分子速度及獲取信息的過程必然產生額外的能量消耗, 產生熵。
洛施密特悖論
洛施密特悖論,又稱可反演性悖論,指出如果對符合具有時間反演性的動力學規律的微觀粒子進行反演,那么系統將產生熵減的結果,這是明顯有悖於熵增加原理的。
針對這一悖論,玻爾茲曼提出:熵增過程確實並非一個單調過程,但對於一個巨觀系統,熵增出現要比熵減出現的機率要大得多;即使達到熱平衡,熵也會圍繞著其最大值出現一定的漲落,且幅度越大的漲落出現機率越小。現在已有的一些實驗結果,與玻爾茲曼的敘述基本相符。
熱力學第二定律是建立在對實驗結果的觀測和總結的基礎上的定律。雖然在過去的一百多年間未發現與第二定律相悖的實驗現象,但始終無法從理論上嚴謹地證明第二定律的正確性。自1993年以來,Denis J.Evans等學者在理論上對熱力學第二定律產生了質疑,從統計熱力學的角度發表了一些關於"熵的漲落"的理論,比如其中比較重要的FT理論。而後G.M.Wang等人於2002在Physical Review Letters上發表了題為《小系統短時間內有悖熱力學第二定律的實驗證明》。從實驗觀測的角度證明了在一定條件下熱,孤立系統的自發熵減反應是有可能發生的。
吉布斯悖論
主條目:吉布斯悖論
玻爾茲曼關係給出了一個並不外延的熵的表示方法。這導致產生了一個明顯有悖於熱力學第二定律的結論,吉布斯悖論--其允許一個封閉系統的熵減少。在通常的解釋中,都會引用量子力學中粒子的不可區分性去說明系統中粒子本身性質並不影響系統的熵來避免產生這一悖論。然而現在有越來越多論文採用如是觀點:熵闡釋的改變恰恰可以忽略由於分子本身排列方式改變所帶來的影響。而現有的Sackur-Tetrode方程對於理想氣體的熵的解釋是外延的。
熱寂論
見:熱寂論
 熱寂
熱寂熱寂論是把熱力學第二定律推廣到整個宇宙的一種理論。宇宙的能量保持不變,宇宙的熵將趨於極大值,伴隨著這一進程,宇宙進一步變化的能力越來越小,一切機械的、物理的、化學的、生命的等多種多樣的運動逐漸全部轉化為熱運動,最終達到處處溫度相等的熱平衡狀態,這時一切變化都不會發生,宇宙處於死寂的永恆狀態。宇宙熱寂說僅僅是一種可能的猜想。
如果將熱力學第一、第二定律運用於宇宙,這一典型的孤立系統,將得到這樣的結論:1.宇宙能量守恆,2.宇宙的熵不會減少。那么將得到,宇宙的熵終將達到極大值,即宇宙將最終達到熱平衡,稱熱寂。
在十九世紀,對於熱寂說有兩個較為有影響的駁斥,一個是由玻爾茲曼提出的"漲落說"(1872),另一個是恩格斯利用運動不滅在《自然辯證法》中進行的駁斥(1876)。現今對於宇宙的理解(1.宇宙在膨脹;2.宇宙,作為自引力系統,是具有負熱容的不穩定系統)指出宇宙是不穩定的熱力學系統,並不像靜態宇宙模型所構想的那樣具有平衡態,因而其熵亦無最大值,即熱寂並不存在。
物理學定律(1)
| 陳述各物理學定律的相關知識點。1.完成有效版本前三名分別獎勵350、200、100百科幣。(任務結束後當周發放);2.內容應符合專業、客觀、中立,具有較強的知識性和專業性,用詞規範、排版美觀、闡釋適度、通俗易懂,符合網際網路閱讀習慣,達到百科詞條的典範之作。請參考:互動百科:詞條標準。3.評審團由物理學專家、科學編輯莫小夏、浪花N朵朵組成。有任何意見、建議可在任務討論區提出。 |