簡介
 Ph
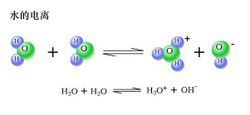
Ph水的電離:水是一種極弱的電解質,可以發生微弱的電離,其電離方程式為:H2O+H2O≒H3O++OH-,簡寫為H2O≒H++OH-,是一個吸熱過程。水的電離受溫度影響,加酸加鹼都能抑制水的電離。水的電離是水分子與水分子之間的相互作用而引起的,因此極難發生。實驗測得,25℃時1L純水中只有1×10^(-7)mol的水分子發生電離。由水分子電離出的H+和OH-數目在任何情況下總相等。25℃時,純水中[H+]=[OH-]=1×10^(-7)mol/L。
水的離子積常數:[H+]·[OH-]=K(W),其中K(W)稱作水的離子積常數,簡稱水的離子積;[H+]和[OH-]是分別是指整個溶液中氫離子和氫氧根離子的總物質的量濃度.K(W)只隨溫度變化而變化,是溫度常數.如25℃,[H+]=[OH-]=1×10^(-7)mol/L,K(W)=1×10^(-14);100℃時,[H+]=[OH-]=1×10^(-6)mol/L,K(W)=1×10^(-12)。
水的pH值
pH值是水溶液最重要的理化參數之一。凡涉及水溶液的自然現象。化學變化以及生產過程都與pH值有關,因此,在工業、農業、醫學、環保和科研領域都需要測量pH值。
水的pH值是表示水中氫離子活度的負對數值,表示為:
pH=-lg[H+]
pH值有時也稱氫離子指數,由於氫離子活度的數值往往很小,在套用上很不方便,所以就用pH值這一概念來作為水溶液酸性、鹼性的判斷指標。而且,氫離子活度的負對數值能夠表示出酸性、鹼性的變化幅度的數量級的大小,這樣套用起來就十分方便,並由此得到(在25℃下):
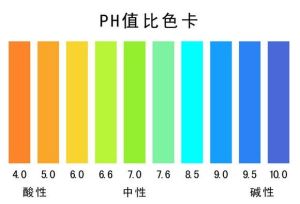
⑴中性水溶液,pH=7
⑵酸性水溶液,pH<7,pH值越小,表示酸性越強;
⑶鹼性水溶液,pH>7,pH值越大,表示鹼性越強。
溶液pH
含義
 Ph
Ph在標準溫度(25℃)和壓力下,pH=7的水溶液(如:純水)為中性,這是因為水在標準溫度和壓力下自然電離出的氫離子和氫氧根離子濃度的乘積(水的離子積常數)始終是1×10^(-14),且兩種離子的濃度都是1×10^(-7)mol/L。pH值小說明H+的濃度大於OH-的濃度,故溶液酸性強,而pH值增大則說明H+的濃度小於OH-的濃度,故溶液鹼性強。所以pH值愈小,溶液的酸性愈強;pH愈大,溶液的鹼性也就愈強。
通常pH值是一個介於0和14之間的數,當pH<7的時候,溶液呈酸性,當pH>7的時候,溶液呈鹼性,當pH=7的時候,溶液呈中性.但在非水溶液或非標準溫度和壓力的條件下,pH=7可能並不代表溶液呈中性,這需要通過計算該溶劑在這種條件下的電離常數來決定pH為中性的值。如373K(100℃)的溫度下,pH=6為中性溶液。
pH計算
在pH的計算中[H+]指的是溶液中氫離子的物質的量濃度(有時也被寫為[H3O+],水合氫離子的物質的量濃度),單位為mol/L(摩爾/升),在稀溶液中,氫離子活度約等於氫離子的濃度,可以用氫離子濃度來進行近似計算。
pH測定
有很多方法來測定溶液的pH值:1.使用pH指示劑。在待測溶液中加入pH指示劑,不同的指示劑根據不同的pH值會變化顏色,根據指示劑的研究就可以確定pH的範圍。滴定時,可以作精確的pH標準。
2.使用pH試紙。pH試紙有廣泛試紙和精密試紙,用玻璃棒蘸一點待測溶液到試紙上,然後根據試紙的顏色變化對照標準比色卡可以得到溶液的pH。pH試紙不能夠顯示出油份的pH值,因為pH試紙以氫離子來量度待測溶液的pH值,但油中沒含有氫離子,因此pH試紙不能夠顯示出油份的pH值。
3.使用pH計。pH計是一種測定溶液pH值的儀器,它通過pH選擇電極(如玻璃電極)來測定出溶液的pH。pH計可以精確到小數點後兩位。
此外還有許多其他更為先進更為精確的pH值測算方法和手段。
)
1適用範圍
1.1本法適用於飲用水、地面水及工業廢水pH值的測定。
1.2水的顏色、濁度、膠體物質、氧化劑、還原劑及高含鹽量均不干擾測定;但在pH<1的強酸性溶液中,會有所謂"酸誤差",可按酸度測定;在pH>10的鹼性溶液中,因有大量鈉離子存在,產生誤差,使讀數偏低,通常稱為"鈉差"。消除"鈉差"的方法,除了使用特製的"低鈉差"電極外,還可似選用與被測溶液的pH值相近似的標準緩衝溶液對儀器進行校正。
溫度影響電極的電位和水的電離平衡。須注意調節儀器的補償裝置與溶液的溫度一致,並使被測樣品與校正儀器用的標準緩衝溶液溫度誤差在±1℃之內。
2定義
pH是從操作上定義的。對於溶液x,測出伽伐尼電池參比電極1KC1濃溶液H溶液×|H2|pt的電動勢EX。將未知pH(X)的溶液X換成標準pH溶液S,同樣測出電池的電動勢ES,則
pH(X)=pH(S)+(Es—Ex)F/(RTIn10)
3原理
pH值由測量電池的電動勢而得。該電池通常由飽和甘汞電極為參比電極,玻璃電極為指示電極所組成。在25℃,溶液中每變化1個pH單位,電位差改變為59.16毫伏,據此在儀器上直接以pH的讀數表示。溫度差異在儀器上有補償裝置。
人體PH
 人體Ph相關
人體Ph相關每個人要知道自己的身體是酸是鹼,就要弄清自己的pH值。通常用pH值來衡量體液的酸鹼度。pH值是溶液中氫離子濃度指數的數值,一般在0~14之間,當pH值為7時溶液為中性,小於7時為酸性,值越小,酸性越強;大於7時呈鹼性,值越大,鹼性越強。人體在正常生理狀態下,血液的pH值精確保持在7.35~7.45之間,為弱鹼性。這個pH值是人體細胞完成生理功能的最佳酸鹼度,少一分或者多一分都不行。人體酸鹼平衡非常重要,如果人體血液pH值低於7.35,會發生酸中毒,而pH值高於7.45則是鹼中毒。無論酸中毒或者鹼中毒,嚴重時會有生命危險。那么我們是不是應該定期檢測自己身體的pH值,防止出現酸鹼失衡呢?
其實,我們的身體有著精巧複雜的設計,從消化系統到排泄系統,再到呼吸系統都精密地控制著酸鹼平衡,變酸可不是容易的事。就拿最先參與酸鹼平衡調節的器官是小腸來說,雖然它並不直接產生酸或者鹼,但可以根據食物的成分來調節對胰液中鹼的再吸收,從而來調節血液中鹼的濃度。小腸還可以通過調節對食物中鹼離子(例如鎂、鈣、鉀等)的吸收來維持酸鹼平衡。大腸也能調節對含硫胺基酸以及有機酸的吸收,一般含硫胺基酸和有機酸由消化系統進入肝臟等器官,經過代謝反應後生成氫離子(酸)或者鹼離子,並釋放到血液中。
 Ph
Ph酸中毒一般是某種疾病的併發症,病因也複雜多樣。比如代謝性酸中毒可由腹膜炎、休克、高熱、腹瀉、腸瘺、急性腎功能衰竭等引起,而呼吸性酸中毒則可由腦膜炎、血栓、脊髓灰質炎、支氣管哮喘以及廣泛性肺疾病引起,另外糖尿病酮症酸中毒是一種比較常見的糖尿病急性代謝併發症。如果你沒有這些嚴重的疾病,不用擔心自己是“酸性體質”,更沒必要天天舉著“家用人體酸鹼儀”來自檢。按照國際常規,檢測體液酸鹼度主要從靜脈血、尿液、體內鹼貯備和二氧化碳結合率等四個方面進行測試,顯然這些專業檢測不是簡單的家用儀器能完成的。
還有一種離譜的說法,認為“酸性體質”是腫瘤的根源。科學家的研究發現,實體腫瘤周圍微環境的pH值的確比正常組織和器官要低。這是因為腫瘤細胞比正常細胞生長快,而在腫瘤組織中血管的供應往往跟不上腫瘤細胞快速擴增的腳步,供應的氧氣和養料不足。腫瘤細胞總是處於缺氧和缺養料的微環境中生長,新陳代謝過程也與正常細胞不同,生成了更多的乳酸等酸性代謝產物,使得腫瘤組織周邊的組織液pH值降低。然而,在腫瘤細胞內部的pH值卻是與正常細胞相同的。需要指出的是,實體腫瘤對體液酸鹼度的影響只局限於腫瘤組織周邊的微環境,目前尚無科學證據表明實體腫瘤會導致整個身體的體液都“變酸”。
有醫學報導,曾有淋巴瘤患者發生嚴重的乳酸中毒併發症,但這在癌症患者中也是非常罕見的。因此,“酸性體質”並不是誘發腫瘤的“惡因”,而是因為腫瘤的生長而導致微環境變酸,或者導致罕見的酸中毒併發症。不過,發現了腫瘤細胞嗜酸的特性,為腫瘤的治療提供了新思路。科學家們正在研製能殺死腫瘤細胞的鹼性藥劑。
4pOH
pOH(氫氧根離子濃度指數)是和pH相對應的表示溶液中氫氧根離子活度的概念,定義如下:
當在298K(25℃)的時候,水的離子積Kw=[H][OH]=10^(-14)因為logKw=log[H]+log[OH],所以此時pOH=14-pH。
pOH值指的是溶液的鹼度,以溶液中OH-(氫氧根離子)濃度來表示,與pH所表示的溶液酸度相對應,pOH等於氫氧根離子的濃度的負常用對數,
即:pOH=-lg[OH-].
根據pOH值可以計算出溶液中氫氧根離子的濃度。
25攝氏度的水溶液中,pOH與pH值關係:
pH+pOH=14.0
所以,pH=14.0-pOH
在計算鹼性溶液的pH時必須先計算出溶液的pOH,再根據pH=14.0-pOH計算出溶液的pH值。
套用
 Ph
Ph![Ph[氫離子濃度指數] Ph[氫離子濃度指數]](/img/5/4fc/nBnauM3X0cTMzAzM1YTMxIDNyITM0IDM2QjMwADMwAzMxAzL2EzLxQzLt92YucmbvRWdo5Cd0FmL0E2LvoDc0RHa.jpg)
