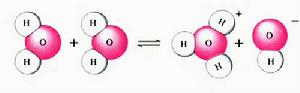簡介
電離的定義
電解質在 水溶液中或熔融狀態下離解成自由移動陰陽離子的過程。將電子從基態激發到脫離原子,叫做電離,這時所需的能量叫電離電勢能。
例如氫原子中基態的能量為-13.6eV( 電子伏特),使電子電離的電離勢能就是13.6eV(即2.18×10-18焦耳)。
簡單點說,就是電解質在水溶液中或熔融狀態下產生自由移動的離子的過程。
陰陽離子
原子是由 原子核及其周圍的帶負電的電子所組成.原子核由帶正電的質子和不帶電的中子構成,由於質子所帶的 原子
原子化學上的電離
 氫離子(H﹢)-模型圖
氫離子(H﹢)-模型圖 H2O→H+ + OH-
2NH3→NH4+ + NH2-
非質子(H+)的自偶電離:
2SO2→SO2+ + SO32-
N2O4→NO+ + NO3-
電離有兩種,一種是化學上的電離,另一種是物理上的電離。
上面講的是化學中的電離。化學上的電離是指電解質在一定條件下(例如溶於某些溶劑、加熱熔化等),電離成可自由移動的離子的過程。在電離前可能是不含有離子(例如氯化氫),也可能是儘管有離子,但是裡面的離子不能自由移動(例如 氯化鈉固體)。
固體溶質進入溶液後,首先發生 微粒(分子或離子)的擴散(吸熱)過程,接著是形成 水合離子或水合分子的水合過程(放熱)。這裡有 化學鍵的破壞和形成,嚴格說都是物理-化學過程。對於強電解質來說, 溶解和電離是難以截然分開的,因為離子的擴散就是電離。不過對於弱電解質說來,首先是擴散成分子(吸熱),然後在水分子作用下,化學鍵被破壞而電離成為水合的自由離子(這裡總體表現是吸熱還是放熱要看破壞化學鍵需要的能量多,還是水合釋放能量多了)。
物理上的電離
物理上的電離是指不帶電的 粒子在高壓電弧或者高能 射線等的作用下,變成了帶電的粒子的過程。例如地球的 大氣層中的 電離層里的粒子就屬於這種情況。電離層中的粒子在宇宙中的高能射線的作用下,電離成了帶電的粒子。電離通常包含物理過程和化學過程,物理過程就是溶解,化學過程不是 化學變化,化學變化除了舊鍵的斷裂還要有新鍵的生成,所以電離不是化學變化。而化學過程指的是在溶劑分子(如水分子)作用下,電解質 中原有的一部分化學鍵斷裂。有的電離過程斷裂的化學鍵是離子鍵,如氯化鈉等大多數 鹽類的電離, 氫氧化鈉等大多數鹼的電離。也有的電離過程斷裂的是 共價鍵,如 硫酸的電離,氯化氫的電離等等。
電離有完全電離和不完全電離之分。 強電解質在水溶液中是完全電離的,如硫酸、氯化鈉、氫氧化鈉等。 弱電解質在水溶液中呈現不完全電離狀態,如氯化汞的電離, 硫化氫的電離等。
應當注意,電離與電解是有區別的。電離過程根本不需要通電(會電離的物質,只要溶解在特定溶劑里就會電離),而電解則需要外部通以電流。
物理電離的方式:高溫 電場 高能輻射