定義
 物質的量
物質的量符號:n
標準:0.012kgC-12中所含的碳原子數
定義:表示含有一定數目粒子的集合體。
在使用物質的量時必須指明基本單元,它可以是組成物質的任何自然存在的原子,分子,電子,離子,光子等一切物質的粒子也可以是按需要人為地將它們進行分割或組合而實際上並不存在的個體或單元).一般利用化學式指明基本單元,而不用漢字。使用摩爾(mole)時基本單元應指明,可以是原子分子及其粒子或這些粒子的特定組合。
| 物理量名稱 | 單位名稱 | 單位符號 |
| 長度 | 米 | m |
| 質量 | 千克、公斤 | kg |
| 時間 | 秒 | s |
| 電流 | 安[培] | A |
| 熱力學溫度 | 開[爾文] | K |
| 物質的量 | 摩[爾] | mol |
| 發光強度 | 坎[德拉] | cd |
常數
 物質的量
物質的量注意<1>1mol任何微粒的粒子數為阿伏伽德羅常數,其不因溫度壓強等條件的改變而改變。
<2>套用阿伏伽德羅定律及理論(在相同的溫度和壓強下,相同體積的任何氣體都含有相同數目的分子)時要滿足:物質在所給溫度,壓強下為氣體
關係
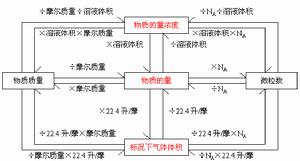
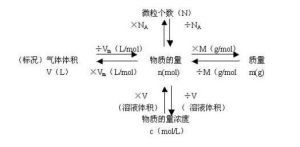
N=n·NA滿足上述關係的粒子是構成物質的基本粒子(如分子、原子、離子、質子、中子、電子)或它們的特定組合.
如:1molCaCl2與阿伏加德羅常數相等的粒子是CaCl2粒子,其中Ca2+為1mol、Cl-為2mol,陰陽離子之和為3mol或原子數為3mol.
在使用摩爾表示物質的量時,應該用化學式指明粒子的種類,而不使用該粒子的中文名稱。例如說“1mol氧”,是指1mol氧原子,還是指1mol氧分子,含義就不明確。又如說“1mol碳原子”,是指1molC-12,還是指1molC-13,含義也不明確。
粒子集體中可以是原子、分子,也可以是離子、質子。中子。電子等。例如:1 mol F,0.5 mol CO2,1k mol CO2-3,a mol e-,1.5 mol Na2CO3·10H2O等。
1mol F中約含6.02×10^23個F原子
0.5mol CO2中約含0.5×6.02×10^23個CO2分子
1k mol CO32-(碳酸根離子)(2-為得到了兩個電子而帶2個單位的負電荷)中約含1000×6.02×10^23個CO32-(2-為它顯負電荷)離子
a mol e-中約含a×6.02×10^23個e-
1.5 mol Na2CO3·10H2O中約含1.5×6.02×10^23個Na2CO3·10H2O,即約含有3×6.02×10^23個Na+、1.5×6.02×10^23個CO3 2-、15×6.02×10^23個H2O.
1mol 近似值為6.02×10^23摩爾質量(M) 單位 g/mol (公式M=m/n) 1.定義:單位物質的量的物質所具有的質量(1mol物質的質量)叫摩爾質量,即1mol該物質所具有相對原子質量與摩爾質量的數值等同。
物質的量(n)、質量(m)、摩爾質量(M)之間的關係為:n=m/M
2.1mol粒子的質量以克為單位時在數值上都與該粒子的相對原子質量(Ar)或相對分子質量(Mr)相等。(摩爾質量的數值與式量相同)
符號
物質的量——n物質的質量——m摩爾質量——M粒子數(微粒的個數)——N
阿伏加德羅常數——NA相對原子質量——Ar
相對分子質量——Mr質量分數——w
氣體摩爾體積——Vm——L/mol——22.4L/mol(在標準狀況下,即在0℃101千帕的條件下)
物質的量濃度——CB(B在C的右下角)——mol/L
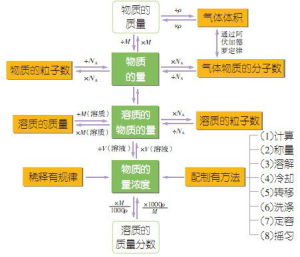
物質的量(mol)=物質的質量(g)/物質的摩爾質量(g/mol)
以單位體積溶液里所含溶質B(B表示各種溶質)的物質的量來表示溶液組成的物理量,叫做溶質B的物質的量濃度。
常用單位:mol/L或mol/m3 。
氣體的體積V=物質的量(mol)x氣體摩爾體積(Vm)
Cρ
W=(C*1L*M)/(1000ml*ρ)×100%拓展:C=(1000·a%·ρ)/M
w(溶質質量分數)
=m溶質/m溶液
=(n*M)/(v*ρ)
=(M*C)/ρ
1000*ρ(密度)*w(溶質質量分數)
c= ——————————————————
M
("———"表示“/”)
公式
n=cvn=N/NA
n=m/M
n=V/Vm
混合物利用平均摩爾質量求物質的量之比:
(M1 M2表示混合物中兩種物質的摩爾質量 M平均 指混合物質的平均摩爾質量)
M1-M平均 n2
—————— = ———
M平均-M2 n1
在台灣被稱為物量
知識
1、掌握物質的量與微粒(原子、分子、離子等)數目,氣體體積之間的相互關係。2、掌握有關物質的量、氣體摩爾體積、溶液的物質的量濃度的計算。
1.物質的量
(1)物質的量是七個基本物理量之一,其意義是表示含有一定量數目的粒子的集體。符號為:n,單位為:摩爾(mol)。
(2)物質的量的基準(NA):以0.012kg12C所含的碳原子數即阿伏加德羅常數作為物質的量的基準。阿伏加德羅常數可以表示為NA,其近似值為6.02×1023mol-1
2.摩爾質量(M)
1摩爾物質的質量,就是該物質的摩爾質量,單位是g/mol。1mol任何物質均含有阿伏加德羅常數個粒子,但由於不同粒子的質量不同,因此,1mol不同物質的質量也不同;12C的相對原子質量為12,而12g12C所含的碳原子為阿伏加德羅常數,即1mol12C的質量為12g。同理可推出1mol其他物質的質量。
【例1】下列關於物質的量的敘述中,錯誤的是()
A.1mol任何物質都含有6.02×1023個分子
B.0.012kg12C中含有約6.02×1023個碳原子
C.1mol水中含有2mol氫和1mol氧
D.1molNe含有6.02×1024個電子
解析:因為有些物質是由分子組成(例如水、硫酸等),有些物質是由離子組成(例如NaCl、Ca(OH)2等),還有些物質是由原子直接構成的(例如金剛石等),所以A的敘述是錯誤的。碳是由原子構成的,根據規定,0.012kg12C中所含的碳原子數即為阿伏加德羅常數,其近似值為6.02×1023mol-1,所以B的敘述是對的。根據規定,“使用摩爾表示物質的量時,應該用化學式指明粒子的種類,而不使用該粒子的中文名稱”。C中表示水的組成時,卻用名稱表示,所以也是不正確的。氖原子核外有10個電子,則1molNe也應含有10×6.02×1023個電子,所以D的敘述是正確的。
答案:AC
【例2】(2010福建卷)表示阿伏伽德羅常數,下列判斷正確的是
A.在18中含有個氧原子
B.標準狀況下,22.4L空氣含有個單質分子
C.1molCl2參加反應轉移電子數一定為2
D.含個的溶解於1L水中,的物質的量濃度為
解析:本題考察阿弗加德羅常數的計算和判斷