簡介
高效液相色譜(high performance liquid chromatography, HPLC)是指流動相為液體的技術。早期的液相色譜(經典液相色譜)是將小體積的試液注入色譜柱上部,然後用洗脫液(流動相)洗脫。這種經典色譜法,流動相依靠自身的重力穿過色譜柱,柱效差(固定相顆粒不能太小),分離時間很長。70年代初期發展起來的高效液相色譜法,克服了經典液相色譜法柱效低,分離時間很長的缺點。成為一種高效、快速的分離技術。高效液相色譜法是在經典色譜法的基礎上,引用了氣相色譜的理論,在技術上,流動相改為高壓輸送(最高輸送壓力可達4.9´107Pa);色譜柱是以特殊的方法用小粒徑的填料填充而成,從而使柱效大大高於經典液相色譜(每米塔板數可達幾萬或幾十萬);同時柱後連有高靈敏度的檢測器,可對流出物進行連續檢測。
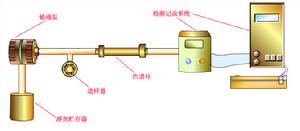 | 高壓泵將貯液罐的流動相經進樣器送入色譜柱中,然後從檢測器的出口流出,這時整個系統就被流動相充滿。當欲分離樣品從進樣器進入時,流經進樣器的流動相將其帶入色譜柱中進行分離,分離後不同組分依先後順序進入檢測器,記錄儀將進入檢測器的信號記錄下來,得到液相色譜圖。 |
| HPLC流程示意 | |
發展歷史
1960年代,由於氣相色譜對高沸點有機物分析的局限性,為了分離蛋白質、核酸等不易氣化的大分子物質,氣相色譜的理論和方法被重新引入經典液相色譜。1960年代末科克蘭(Kirkland)、哈伯、荷瓦斯(Horvath)、莆黑斯、里普斯克等人開發了世界上第一台高效液相色譜儀,開啟了高效液相色譜的時代。高效液相色譜使用粒徑更細的固定相填充色譜柱,提高色譜柱的塔板數,以高壓驅動流動相,使得經典液相色譜需要數日乃至數月完成的分離工作得以在幾個小時甚至幾十分鐘內完成。
1971年科克蘭等人出版了《液相色譜的現代實踐》一書,標誌著高效液相色譜法 (HPLC)正式建立。在此後的時間裡,高效液相色譜成為最為常用的分離和檢測手段,在有機化學、生物化學、醫學、藥物開發與檢測、化工、食品科學、環境監測、商檢和法檢等方面都有廣泛的套用。高效液相色譜同時還極大的刺激了固定相材料、檢測技術、數據處理技術以及色譜理論的發展。
1960年代前,使用的填充粒大於100μm,提高柱效面臨著困境,後來的研究人員便採用微粒固定相來突破著一瓶頸。科克蘭、荷瓦斯製備成功薄殼型固定相,這種在固定相在玻璃微球表面具有多孔薄殼,實現了高速傳質,為高效液相色譜技術的發展奠定了穩固的基礎。隨著填料粒徑的降低,更高的柱效也得以實現。1960年代研製出氣動放大泵、注射泵及低流量往復式柱塞泵,但後者的脈衝信號很大,難以滿足高效液相色譜的要求。1970年代,往復式雙柱塞恆流泵,解決了這一問題。1970年代後科克蘭製備出全多孔球形矽膠,平均粒徑只有7μm,具有極好的柱效,並逐漸取代了無定形微粒矽膠。之後又製造出的鍵合固定相使柱的穩定性大為提高,多次使用成為可能。1970年後,適合分離生物大分子的填料又成為研究的熱點。1980年後,改善分離的選擇性成為色譜工作者的主要問題,人們越來越認識到改變流動相的組成事提高選擇性的關鍵。
特點
1.高壓:液相色譜法以液體為流動相(稱為載液),液體流經色譜柱,受到阻力較大,為了迅速地通過色譜柱,必須對載液施加高壓。一般可達150~350×105Pa。
2. 高速:流動相在柱內的流速較經典色譜快得多,一般可達1~10ml/min。高效液相色譜法所需的分析時間較之經典液相色譜法少得多,一般少於1h。
3. 高效:近來研究出許多新型固定相,使分離效率大大提高。
4.高靈敏度:高效液相色譜已廣泛採用高靈敏度的檢測器,進一步提高了分析的靈敏度。如螢光檢測器靈敏度可達10-11g。另外,用樣量小,一般幾個微升。
5.適應範圍寬:氣相色譜法與高效液相色譜法的比較:氣相色譜法雖具有分離能力好,靈敏度高,分析速度快,操作方便等優點,但是受技術條件的限制,沸點太高的物質或熱穩定性差的物質都難於套用氣相色譜法進行分析。而高效液相色譜法,只要求試樣能製成溶液,而不需要氣化,因此不受試樣揮發性的限制。對於高沸點、熱穩定性差、相對分子量大(大於 400 以上)的有機物(這些物質幾乎占有機物總數的 75% ~ 80% )原則上都可套用高效液相色譜法來進行分離、分析。 據統計,在已知化合物中,能用氣相色譜分析的約占20%,而能用液相色譜分析的約占70~80%。
主要類型
1、吸附色譜(Adsorption Chromatography)
2、分配色譜(Partition Chromatography)
3、離子色譜(Ion Chromatography)
4、體積排阻色譜(Size Exclusion Chromatography)
5、親和色譜(Affinity Chromatography)
特點比較
吸附色譜 | 分配色譜 | 離子色譜 | 親和色譜 | ||
固定相 | 全多孔固體吸附劑 | 固定液載帶在固相基體上 | 高效微粒離子交換劑 | 具有不同孔徑的多孔性凝膠 | 多種不同性能的配位體鍵聯在固相基體上 |
流動相 | 不同極性有機溶劑 | 不同極性有機溶劑和水 | 不同pH值的緩衝溶液 | 有機溶劑或一定pH值的緩衝溶液 | 不同pH值的緩衝溶液,可加入改性劑 |
分離原理 | 吸附與解吸 | 溶解與揮發 | 可逆性的離子交換 | 多孔凝膠的滲透或過濾 | 具有鎖匙結構絡合物的可逆性離解 |
分離原理
根據分離機制的不同,高效液相色譜法可分為下述幾種主要類型:
1 .液—液分配色譜法(Liquid-liquid Partition Chromatography)及化學鍵合相色譜(Chemically Bonded Phase Chromatography)
流動相和固定相都是液體。流動相與固定相之間應互不相溶(極性不同,避免固定液流失),有一個明顯的分界面。當試樣進入色譜柱,溶質在兩相間進行分配。達到平衡時,服從於下式:式中,cs—溶質在固定相中濃度;cm--溶質在流動相中的濃度; Vs—固定相的體積;Vm—流動相的體積。LLPC與GPC有相似之處,即分離的順序取決於K,K大的組分保留值大;但也有不同之處,GPC中,流動相對K影響不大,LLPC流動相對K影響較大。
a. 正相液 — 液分配色譜法(Normal Phase liquid Chromatography): 流動相的極性小於固定液的極性。
b. 反相液 — 液分配色譜法(Reverse Phase liquid Chromatography): 流動相的極性大於固定液的極性。
c. 液 — 液分配色譜法的缺點:儘管流動相與固定相的極性要求完全不同,但固定液在流動相中仍有微量溶解;流動相通過色譜柱時的機械衝擊力,會造成固定液流失。上世紀70年代末發展的化學鍵合固定相(見後),可克服上述缺點。現在套用很廣泛(70~80%)。
2 .液—固色譜法
流動相為液體,固定相為吸附劑(如矽膠、氧化鋁等)。這是根據物質吸附作用的不同來進行分離的。其作用機制是:當試樣進入色譜柱時,溶質分子 (X) 和溶劑分子(S)對吸附劑表面活性中心發生競爭吸附(未進樣時,所有的吸附劑活性中心吸附的是S),可表示如下:
Xm nSa ====== Xa nSm
式中:Xm--流動相中的溶質分子;Sa--固定相中的溶劑分子;Xa--固定相中的溶質分子;Sm--流動相中的溶劑分子。
當吸附競爭反應達平衡時:
K=[Xa][Sm]/[Xm][Sa]
式中:K為吸附平衡常數。[討論:K越大,保留值越大。]
3 .離子交換色譜法(Ion-exchange Chromatography)
IEC是以離子交換劑作為固定相。IEC是基於離子交換樹脂上可電離的離子與流動相中具有相同電荷的溶質離子進行可逆交換,依據這些離子以交換劑具有不同的親和力而將它們分離。
以陰離子交換劑為例,其交換過程可表示如下:
X-(溶劑中) (樹脂-R4N Cl-)=== (樹脂-R4N X-) Cl- (溶劑中)
當交換達平衡時:
KX=[-R4N X-][ Cl-]/[-R4N Cl-][ X-]
分配係數為:
DX=[-R4N X-]/[X-]= KX [-R4N Cl-]/[Cl-]
[討論:DX與保留值的關係]
凡是在溶劑中能夠電離的物質通常都可以用離子交換色譜法來進行分離。
4 .離子對色譜法(Ion Pair Chromatography)
離子對色譜法是將一種 ( 或多種 ) 與溶質分子電荷相反的離子 ( 稱為對離子或反離子 ) 加到流動相或固定相中,使其與溶質離子結合形成疏水型離子對化合物,從而控制溶質離子的保留行為。其原理可用下式表示:
式中:X 水相--流動相中待分離的有機離子(也可是陽離子);Y-水相--流動相中帶相反電荷的離子對(如氫氧化四丁基銨、氫氧化十六烷基三甲銨等);X Y---形成的離子對化合物。
當達平衡時:
KXY = [X Y-]有機相/[ X ]水相[Y-]水相
根據定義,分配係數為:
DX= [X Y-]有機相/[ X ]水相= KXY [Y-]水相
[討論:DX與保留值的關係]
離子對色譜法(特別是反相)發解決了以往難以分離的混合物的分離問題,諸如酸、鹼和離子、非離子混合物,特別是一些生化試樣如核酸、核苷、生物鹼以及藥物等分離。
5.離子色譜法(Ion Chromatography)
用離子交換樹脂為固定相,電解質溶液為流動相。以電導檢測器為通用檢測器,為消除流動相中強電解質背景離子對電導檢測器的干擾,設定了抑制柱。試樣組分在
分離柱和抑制柱上的反應原理與離子交換色譜法相同。以陰離子交換樹脂(R-OH)作固定相,分離陰離子(如Br-)為例。當待測陰離子Br-隨流動相(NaOH)進入色譜柱時,發生如下交換反應(洗脫反應為交換反應的逆過程):
抑制柱上發生的反應:
R-H Na OH- === R-Na H2O
R-H Na Br- === R-Na H Br-
可見,通過抑制柱將洗脫液轉變成了電導值很小的水,消除了本底電導的影響;試樣陰離子Br-則被轉化成了相應的酸H Br-,可用電導法靈敏的檢測。
離子色譜法是溶液中陰離子分析的最佳方法。也可用於陽離子分析。
6.空間排阻色譜法(Steric Exclusion Chromatography)
空間排阻色譜法以凝膠 (gel) 為固定相。它類似於分子篩的作用,但凝膠的孔徑比分子篩要大得多,一般為數納米到數百納米。溶質在兩相之間不是靠其相互作用力的不同來進行分離,而是按分子大小進行分離。分離只與凝膠的孔徑分布和溶質的流動力學體積或分子大小有關。試樣進入色譜柱後,隨流動相在凝膠外部間隙以及孔穴旁流過。在試樣中一些太大的分子不能進入膠孔而受到排阻,因此就直接通過柱子,首先在色譜圖上出現,一些很小的分子可以進入所有膠孔並滲透到顆粒中,這些組分在柱上的保留值最大,在色譜圖上最後出現。
固定相
一、液—液色譜法及離子對色譜法固定相
與GLC類似,LLC的固定相也是在擔體上塗漬一層固定液構成,或使用化學鍵合相。
1.擔體
所用的擔體可分為如下幾類:
(1) 全多孔型擔體:
a. HPLC早期使用的擔體與GC類似,是顆粒均勻的多孔球體,如有氧化鋁、氧化矽、硅藻土等製成的Φ»100 μm全多孔型擔體。其缺點是:填料的不規則性和較寬的粒度範圍會導致填充不易均勻,柱效低;填料孔徑分布不一,並存在“裂隙”在填料深孔中形成滯留液體(液坑),溶質分子在深孔中擴散和傳質慢,使色譜峰變寬,柱效下降。
(2) 表層多孔型擔體(薄殼型微珠擔體):
它是直徑為 30 ~ 40 μm 的實心核 ( 玻璃微珠 ) ,表層上附有一層厚度約為 1~ 2μm 多孔表面 ( 多孔矽膠 ) 。 其優點是:孔穴淺(固定相僅為表面的一薄層),傳質速度快,易於填充均勻,柱效高。其缺點是:柱子容量低、需要配用高靈敏檢測器。
這種擔體目前套用較為普遍。
2.固定液
液—液色譜流動相和固定相都是液體,因此要求兩相要互不相溶。在液-液色譜中常用的固定也只有極性不同的幾種,如β,β'-氧二丙腈、聚已二醇-400和角鯊烷等。
3.化學鍵合固定相:
將固定液機械的塗在擔體表面上構成的這種固定相,在實際使用時存在不少缺點,20世紀60年末發展起來了一種新型的固定相---化學鍵合固定相。
即用化學反應的方法通過化學鍵把有機分子結合到擔體表面。根據在矽膠表面 (具有≡Si-OH基團) 的化學反應不同,鍵合固定相可分為:矽氧碳鍵型 ( ≡ Si-O-C ) ;矽氧矽碳鍵型 (≡Si-O-Si-C ) 矽碳鍵型(≡Si-C)和矽氮鍵型(≡Si-N)四種類型。
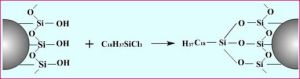 化學鍵合固定相反應
化學鍵合固定相反應ⅰ.表面沒有液坑,比一般液體固定相傳質快得多;
ⅱ.無固定液流失,增加了色譜柱的穩定性和壽命;
ⅲ.可以鍵合不同官能團,能靈活地改變選擇性,套用於多種色譜類型及樣品的分析;
ⅳ.有利於梯度洗提,也有利於配用靈敏的檢測器和餾分的收集。
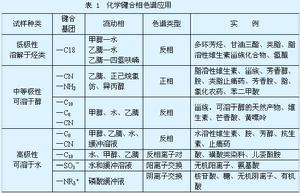 化學鍵合固定相套用
化學鍵合固定相套用二、液-固吸附色譜法固定相
採用的吸附劑有矽膠、氧化鋁、分子篩、聚醯胺等,仍可分為全多孔性和薄殼型兩種,其特點如前所述。
三、離子交換色譜法固定相1.薄膜型離子交換樹脂:即以薄殼玻璃珠為擔體,在它的表面塗約 1% 的離子交換樹脂而成。
2. 離子交換鍵合固定相:用化學反應將離子交換基團鍵合在惰性擔體(如微粒矽膠)表面。
樹脂類別:(1)陽離子交換樹脂(強酸性、弱酸性);(2)陰離子交換樹脂(強鹼性、弱鹼性)。
四、排阻色譜法固定相
1.軟質凝膠:如交聯葡聚糖凝膠、瓊脂糖凝膠等,適用於水為流動相,在常壓下使用。
2.半硬質凝膠:如苯乙烯-二乙烯基苯交聯共聚凝膠(交聯聚苯乙烯凝膠),是套用最多的有機凝膠,適用於非極性有機溶劑。
3.硬質凝膠:如多孔矽膠、多孔玻璃等,多孔矽膠是用得較多的無機凝膠。
化學穩定性、熱穩定性好、機械強度大,流動相性質影響小,可在較高流速下使用。
近年來發展起來的可控孔徑玻璃微球,具有恆定孔徑和窄粒度分布。用它固定相,色譜柱易填充均勻;柱壓、流動相流速、pH值或離子強度對分離的影響小,適用於較高流速下操作。
流動相
在氣相色譜中,載氣是惰性的(與組分分子之間的作用力可忽略不計),常用的只有三四種,他們的性質差異也不大,所以要提高柱子的選擇性,只要選擇合適的固定相即可。但在液相色譜中,當固定相選定後,流動相的種類、配比能顯著的影響分離效果,因此,流動相的選擇也非常重要。
選擇流動相(又稱為:淋洗液,洗脫劑)時應注意下列幾個因素。
(1) 流動相純度:防止微量雜質長期累積損壞色譜柱和使檢測器噪聲增加。
(2) 避免流動相與固定相發生作用而使柱效下降或損壞柱子。如在液-液色譜中,流動相應與固定液互不相溶,否則,會使固定液溶解流失;酸性溶劑破壞氧化鋁固定相等。
(3) 對試樣要有適宜的溶解度:試樣在流動相中應有適宜的溶解度,防止產生沉澱並在柱中沉積。
(4) 溶劑的粘度小些為好:否則,會降低試樣組分的擴散係數,造成傳質速率緩慢,柱效下降。
(5) 應與檢測器相匹配:例如,當使用紫外檢測器時,流動相不應有紫外吸收。
在選擇溶劑時,溶劑的極性是選擇的重要依據。例如,採用正相液-液分配分離時:首先選擇中等極性溶劑,若組分的保留時間太短,降低溶劑極性,反之增加。也可在低極性溶劑中,逐漸增加其中的極性溶劑,使保留時間縮短。
常用溶劑的極性順序:
水(最大) > 甲醯胺> 乙腈> 甲醇> 乙醇> 丙醇> 丙酮>二氧六環> 四氫呋喃> 甲乙酮> 正丁醇> 乙酸乙酯> 乙醚> 異丙醚> 二氯甲烷>氯仿>溴乙烷>苯>四氯化碳>二硫化碳>環己烷>己烷>煤油(最小)。
除此之外,在選擇溶劑時,溶劑的極性是最重要的依據,有時還需要採用二元或多元組合溶劑作為流動相,以靈活調節流動相的極性或增加選擇性,以改進分離或調整出峰時間。選擇時要參閱有關手冊,並通過實驗確定。
高效液相色譜儀
HPLC的出現不過三十多年的時間,但這種分離分析技術的發展十分迅猛,目前套用也十分廣泛。其儀器結構和流程也多種多樣。典型的高效液相色譜儀結構和流程可用下列方框圖表示(See Fig.3-4)。高效液相色譜儀一般都具備貯液器、高壓泵、梯度洗提裝置(用雙泵)、進樣器、色譜柱、檢測器、恆溫器、記錄儀等主要部件。
1、高壓泵
HPLC使用的色譜柱是很細的(1~6 mm),所用固定相的粒度也非常小(幾μm到幾十μm),所以流動相在柱中流動受到的阻力很大,在常壓下,流動相流速十分緩慢,柱效低且費時。為了達到快速、高效分離,必須給流動相施加很大的壓力,以加快其在柱中的流動速度。為此,須用高壓泵進行高壓輸液。高壓、高速是高效液相色譜的特點之一。
HPLC使用的高壓泵應滿足下列條件:
a.流量恆定,無脈動,並有較大的調節範圍(一般為1~10 mL/min);
b.能抗溶劑腐蝕;
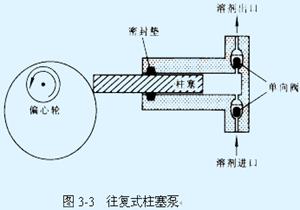 往復式柱塞泵
往復式柱塞泵c.有較高的輸液壓力;對一般分離,60×105Pa的壓力就滿足了,對高效分離,要求達到150~300×105Pa。
(1). 往復式柱塞泵
當柱塞推入缸體時,泵頭出口(上部)的單向閥打開,同時,流動相進入的單向閥(下部)關閉,這時就輸出少量的流體。反之,當柱塞向外拉時,流動相入口的單向閥打開,出口的單向閥同時關閉,一定量的流動相就由其儲液器吸入缸體中。這種泵的特點是不受整個色譜體系中其餘部分阻力稍有變化的影響,連續供給恆定體積的流動相。
(2)氣動放大泵
其工作原理是:壓力為 p1 的低壓氣體推動大面積( SA )活塞 A ,則在小面積( SB )活塞 B 輸出壓力增大至 p2 的液體。壓力增大的倍數取決於 A 和 B 兩活塞的面積比,如果 A 與 B 的面積之比為 50 : 1 ,則壓力為 5 × Pa 的氣體就可得到壓力為 250×Pa 的輸出液體。這是一種恆壓泵。
2、梯度洗提
類似於GC中的程式升溫。已成為現代高效液相色譜中部缺少的部分。梯度洗提,就是載液中含有兩種(或更多)不同極性的溶劑,在分離過程中按一定的程式連續改變載液中溶劑的配比和極性,通過載液中極性的變化來改變被分離組分的分離因素,以提高分離效果。梯度洗提可以分為兩種:
a.低壓梯度(也叫外梯度):在常壓下,預先按一定程式將兩種或多種不同極性的溶劑混合後,再用一台高壓泵輸入色譜柱。
b.高壓梯度 ( 或稱內梯度系統 ) :利用兩台高壓輸液泵,將兩種不同極性的溶劑按設定的比例送入梯度混合室,混合後,進入色譜柱。
3、進樣裝置
(1).注射器進樣裝置:進樣所用微量注射器及進樣方式與 GC法一樣。進樣壓力150×105Pa時,必須採用停流進樣。
(2).高壓定量進樣閥:與GC法用的流通法相似,能在高壓下進樣。
4、色譜柱
色譜柱是色譜儀最重要的部件(心臟)。通常用後壁玻璃管或內壁拋光的不鏽鋼管制作的,對於一些有腐蝕性的樣品且要求耐高壓時,可用銅管、鋁管或聚四氟乙烯管。柱子內徑一般為1~6 mm。常用的標準柱型是內徑為 4.6 或 3.9mm ,長度為 15 ~ 30cm 的直形不鏽鋼柱。填料顆粒度 5 ~ 10μm ,柱效以理論塔板數計大約 7000 ~ 10000 。發展趨勢是減小填料粒度和柱徑以提高柱效。
5、檢測器
(1).紫外光度檢測器
它的作用原理是基於被分析試樣組分對特定波長紫外光的選擇性吸收,組分濃度與吸光度的關係遵守比爾定律。
最常用的檢測器,套用最廣,對大部分有機化合物有回響。
特點:
a.靈敏度高:其最小檢測量10-9g·mL-1,故即使對紫外光吸收很弱的物質,也可以檢測;
b.線性範圍寬;(比爾定律)
c.流通池可做的很小(1mm × 10mm ,容積 8μL);
d.對流動相的流速和溫度變化不敏感,可用於梯度洗脫;
e.波長可選,易於操作:如,使用裝有流通池的可見紫外分光光度計(可變波長檢測器)。
缺點:對紫外光完全不吸收的試樣不能檢測;同時溶劑的選擇受到限制。
(2). 光電二極體陣列檢測器
紫外檢測器的重要進展;陣列由1024個光電二極體陣列,每個光電二極體寬僅50μm,各檢測一窄段波長。如圖所示,在檢測器中,光源發出的紫外或可見光通過液相色譜流通池,在此流動相中的各個組分進行特徵吸收,然後通過狹縫,進入單色其進行分光,最後由光電二極體陣列檢測,得到各個組分的吸收信號。經計算機快速處理,得三維立體譜圖。
(3).螢光檢測器
螢光檢測器是一種高靈敏度、高選擇性檢測器。
對多環芳烴,維生素B、黃麴黴素、卟啉類化合物、農藥、藥物、胺基酸、甾類化合物等有回響。
螢光檢測器的結構及工作原理和螢光光度計相似。
(4).差示折光檢測器
除紫外檢測器之外套用最多的檢測器。
差示折光檢測器是借連續測定流通池中溶液折射率的方法來測定試樣濃度的檢測器。溶液的折射率是純溶劑(流動相)和純溶質(試樣)折射率乘以各物質的濃度之和。因此溶有試樣的流動相和純流動相之間折射率之差表示試樣在流動相中的濃度。
(5).電導檢測器
其作用原理是根據物質在某些介質中電離後所產生電導變化來測定電離物質含量。
設備選型
要正確地選擇色譜分離方法,首先必須儘可能多的 了解樣品的有關性質,其次必須熟悉各種色譜方法的主要特點及其套用範圍。
選擇色譜分離方法的主要根據是樣品的相對分子質量的大小,在水中和有機溶劑中的溶解度,極性和穩定程度以及化學結構等物理、化學性質。
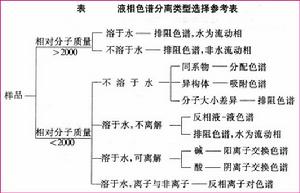 選型常用參照表
選型常用參照表1、相對分子質量
對於相對分子質量較低(一般在200以下),揮發性比較好,加熱又不易分解的樣品,可以選擇氣相色譜法進行分析。相對分子質量在200 ~ 2000的化合物,可用液固吸附、液-液分配和離子交換色譜法。相對分子質量高於2000,則可用空間排阻色譜法。
2、溶解度
水溶性樣品最好用離子交換色譜法和液液分配色譜法;微溶於水,但在酸或鹼存在下能很好電離的化合物,也可用離子交換色譜法;油溶性樣品或相對非極性的混合物,可用液-固色譜法。
3、化學結構
若樣品中包含離子型或可離子化的化合物,或者能與離子型化合物相互作用的化合物(例如配位體及有機螯合劑),可首先考慮用離子交換色譜,但空間排阻和液液分配色譜也都能順利地套用於離子化合物;異構體的分離可用液固色譜法;具有不同官能團的化合物、同系物可用液液分配色譜法;對於高分子聚合物,可用空間排阻色譜法。
HPLC分析方法
通常在確定被分析的樣品以後,要建立一種高效液相色譜分析方法必須解決以下問題:
①根據被分析樣品的特性選擇適用於樣品分析的一種高效液相色譜分析方法。
②選擇一根適用的色譜柱,確定柱的規格(柱內徑及柱長)和選用固定相(粒徑及孔徑)。
③選擇適當的或最佳化的分離操作條件,確定流動相的組成、流速及洗脫方式。
④由獲得的色譜圖進行定性分析和定量分析。
套用實例
氣相色譜法與高效液相色譜法的比較:氣相色譜法雖具有分離能力好,靈敏度高,分析速度快,操作方便等優點,但是受技術條件的限制,沸點太高的物質或熱穩定性差的物質都難於套用氣相色譜法進行分析。而高效液相色譜法,只要求試樣能製成溶液,而不需要氣化,因此不受試樣揮發性的限制。對於高沸點、熱穩定性差、相對分子量大(大於400以上)的有機物(這些物質幾乎占有機物總數的75%~80%)原則上都可套用高效液相色譜法來進行分離、分析。據統計,在已知化合物中,能用氣相色譜分析的約占20%,而能用液相色譜分析的約占70~80%。
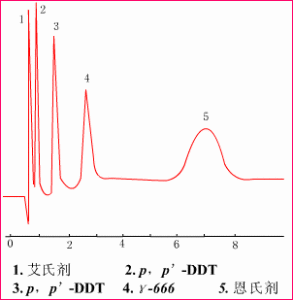 實時監測圖
實時監測圖固定相:薄殼型矽膠(37 ~50mm)
流動相:正己烷
流速:1.5 mL/min
色譜柱:50cm´2.5mm(內徑)
檢測器:差示折光檢測器
可對水果、蔬菜中的農藥殘留量進行分析
|
| 實時監測圖 |
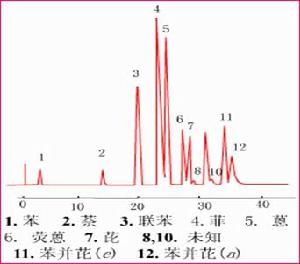
稠環芳烴多為致癌物質。
固定相:十八烷基矽烷化鍵合相
流動相:20%甲醇-水 ~100%甲醇;線性梯度淋洗,2%/min
流速:1mL/min
柱溫:50 ºC
柱壓:70 ´104 Pa
檢測器:紫外檢測器
3、陰離子分析
雙柱;薄殼型陰離子交換樹脂分離柱(3×250mm),
流動相:0.003mol·L-1 NaHCO3 / 0.0024 mol·L-1 Na2CO3,流量138 mL/hr。
七種陰離子在20分鐘內基本上得到完全分離,各組分含量在3~50 ppm。
操作方法
下列優良常規操作能夠最大限度降低維修費用:
1、使用HPLC級試劑和流動相
2、清潔的儀器、流動相和樣品
3、如果必要,進行過濾
4、保證溶劑的相溶性
5、如果必要,沖洗整個系統,去掉鹽,防止污染
6、對儀器的使用、維護和保養進行記錄
發酵工程設備
| 發酵工程設備常見設備介紹以及生產能力計算 |