概述
膠體金(colloidal gold),又稱金溶膠(gold solution),是指分散相粒子直徑在l—150nm之間的金溶膠,屬於多相不均勻體系,顏色呈桔紅色到紫紅色。膠體金可以作為標記物用於免疫組織化學,近10多年來膠體金標記已經發展為一項重要的免疫標記技術。膠體金免疫分析在藥物檢測、生物醫學等許多領域的研究已經得到發展,並越來越受到相關研究領域的重視。
結構
 膠體金
膠體金膠體金顆粒的基礎金核並非是理想的圓球核,較小的膠體金顆粒基本是圓球形的,較大的膠體金顆粒(一般指大於30nm以上的)多呈橢圓形。在電子顯微鏡下可觀察膠體金的顆粒形態。
特徵性質
 膠體金
膠體金光吸收性膠體金在可見光範圍內有一單一光吸收峰,這個光吸收峰的波長(λmax)在510~550nm範圍內,隨膠體金顆粒大小而變化,大顆粒膠體金的λmax偏向長波長,反之,小顆粒膠體金的λmax則偏於短波長。
鑑定保存
膠體金的製備並不難,但要制好高質量的膠體金卻也並非易事。因此對每次制好的膠體金應加以檢定,主要檢查指標有顆粒大小,粒徑的均一程度及有無凝集顆粒等。在日光下仔細觀察比較膠體金的顏色,可以粗略估計製得的金顆粒的大小。當然也可用分光光度計掃描λmax來估計金顆粒的粒徑。製備的膠體金最好作電鏡觀察,並選一些代表性的作顯微攝影,可以比較精確地測定膠體金的平均粒徑;良好的膠體金應該是清亮透明的,若製備的膠體金混濁或液體表面有漂浮物,提示此次製備的膠體金有較多的凝集顆粒。
膠體金在潔淨的玻璃器皿中可較長時間保存,加入少許防腐劑(如0.02%NaN3)可有利於保存。保存不當時會有細菌生長或有凝集顆粒形成。少量凝集顆粒並不影響以後膠體金的標記,使用時為提高標記效率可先低速離心去除凝集顆粒。
發展簡史
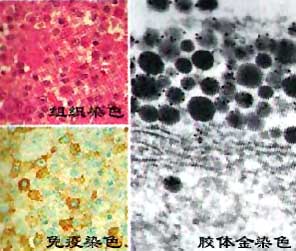 膠體金標記技術
膠體金標記技術膠體金作為標記物用於免疫組織化學始於1971年,Faulk等套用電鏡免疫膠體金染色法(IGS)觀察沙門氏菌,此後他們把膠體金與多種蛋白質結合.1974年Romano等將膠體金標記在第二抗體(馬抗人IgG)上,建立了間接免疫膠體金染色法。1978年geoghega發現了膠體金標記物在光鏡水平的套用。膠體金在免疫化學中的這種套用,又被稱為免疫金.之後,許多學者進一步證實膠體金能穩定又迅速地吸附蛋白質,而蛋白質的生物活性無明顯改變.它可以作為探針進行細胞表面和細胞內多糖、蛋白質、多膚、抗原、激素、核酸等生物大分子的精確定位,也可以用於日常的免疫診斷,進行免疫組織化學定位,因而在臨床診斷及藥物檢測等方面的套用已受到廣泛的重視.目前電鏡水平的免疫金染色(IGS),光鏡水平的免疫金銀染色(IGSS),以及肉眼水平的斑點免疫金染色技術日益成為科學研究和臨床診斷的有力工具.膠體性質膠體金顆粒大小多在1~100nm,微小金顆粒穩定地、均勻地、呈單一分散狀態懸浮在液體中,成為膠體金溶液。近10多年來膠體金標記已經發展為一項重要的免疫標記技術.膠體金免疫分析在藥物檢測、生物醫學等許多領域的研究已經得到發展,並越來越受到相關研究領域的重視。
製備方法
氯金酸(HauC14)是主要還原材料,通過各種方法進行還原製備金溶膠,常用還原劑有檸檬酸鈉、鞣酸、抗壞血酸、白磷、硼氫化鈉等。根據還原劑類型以及還原作用的強弱,可以製備0.8nm~150nm不等的膠體金。常見的製備方法有一下幾種:
1、紫外光引發還原可製備金溶膠—— 其還原過程經歷了自由基機理。用紫外可見光譜觀察了不同反應時間溶膠狀態的變化。結果表明,光照反應2h時明顯出現金溶膠粒子,7h後氯金酸基本轉化完畢。 同時,研究了穩定劑聚乙烯吡咯烷酮(PVP)的加入對還原過程的影響,結果表明,PVP的加入不僅穩定了溶膠,而且降低了反應速率.用SEM觀察了溶膠粒子聚集體的形貌.最後以1,4-bis(4-vinylpyridyl)phenylene為探針分子研究了這種溶膠的SERS活性.
2、納米金溶膠製備——以水為分散介質,PVP為分散劑,抗壞血酸作還原劑,用較高濃度的氯金酸溶液,在弱酸性條件下,通過化學還原法製得球狀、最大粒徑為20nm的金溶膠 結果表明,還原劑用量為抗壞血酸/Au(摩爾比)=3,PVP的用量取PVP/HAuCl4(質量比)=1,還原體系自身pH值3~5,常溫293K為金溶膠製備的最佳條件.在此條件下製得的金粉粒度小,分散性好,且十分穩定,無反溶現象.
3、磷鉬酸作為光催化還原劑製備納米金溶膠——由於DMF與磷鉬雜多陰離子間的電荷轉移作用,導致鉬系雜多酸可成為製備納米金溶膠的光催化還原劑. 實驗結果表明,紫外光照作用及光照時間、DMF用量等是影響納米金的形成和形貌的主要因素,選擇適宜的合成條件可以得到粒徑均勻、分散性好的納米金溶膠.
4、超短脈衝雷射誘導製備金溶膠的方法——其製法為以氯金酸濃度在0~5mmol/L範圍內的水溶液作為反應溶液,調節可見/近紅外超短脈衝雷射光束並聚焦,利用焦點附近的光束輻照氯金酸水溶液來製備金溶膠。本發明的製備方法工藝和裝置簡單,無需還原劑的引入,製備的金溶膠濃度高,穩定性好,雜質含量非常低,可用作高級非線性光學薄膜的前驅體,催化材料,也可用作食品、飲料及化妝品的添加劑。
6、一種採用雷射轟擊固液界面連續製備純淨金溶膠——本發明系採用聚焦脈衝雷射束在適當氣體保護下轟擊浸於連續流動液相中的,不斷相對移位的金靶表面,在固液界面產生高溫高壓微區而生成純淨的金溶膠流出反應器。本發明方法可連續製備純淨的金溶膠,不含過量還原劑及其反應副產物、保護劑、分散劑等有害雜質,無須提純,作為添加劑可直接套用於微電子器件、超大規模集成晶片、醫學、免疫標記以及食品、飲料、飲用水、酒類、化妝品等行業。
套用
 膠體金
膠體金膠體金套用電鏡水平的研究最早,發展最快,套用最廣泛。其最大優點是可以通過套用不同大小的顆粒或結合酶標進行雙重或多重標記。直徑為3~15nm膠體金均可用作電鏡水平的標記物。3~15nm的膠體金多用於單一抗原顆粒的檢測,而直徑15nm多用於檢測量較多的感染細胞。
膠體金用於電鏡水平的研究,主要包括:①細胞懸液或單層培養中細胞表面抗原的觀察。②單層培養中細胞內抗原的檢測。③組織抗原的檢測。
金標記在電鏡水平的套用,主要方法包括:包埋前染色、包埋後染色、免疫負染色、雙標記技術和原位雜交技術等。
實驗證明,該法樣本用量少、檢測速度快、對比明顯、操作簡單、敏感性和特異性高,既可用於抗原檢測,也可用於抗體檢測,因此,可同時適用於科研和診斷。
2、膠體金在光鏡水平的套用
膠體金同樣可用做光鏡水平的標記物,取代傳統的螢光素、酶等。各種細胞塗片、切片均可套用。主要用於:①用單克窿抗體或抗血清檢測細胞懸液或培養的單層細胞的膜表面抗原。②檢測培養的單層細胞胞內抗原,③組織中或亞薄切片中抗原的檢測。
膠體金用於光鏡水平的研究,可以彌補其它標記物不可避免的本底過高和內部酶活性干擾等缺點。
3、膠體金在流式細胞儀中的套用:
套用螢光素標記的抗體,通過流式細胞儀計數分析細胞表面抗原,是免疫學研究中的重要技術之一。但由於不同螢光素的光譜相互重疊,區分不同的標記困難,因此必須尋找一種非螢光素標記物,用於流式細胞計數。這樣可以同時進行幾種標記。該標記物必須能夠改變散射角,膠體金可以明顯地改變紅雷射散射角,因而可以作為流式細胞儀的標記物之一。
4、凝集試驗:單分散的免疫金溶膠呈清澈透明的溶液,其顏色隨溶膠顆粒大小而變化,當與相應抗原或抗體發生專一性反應後出現凝聚,溶膠顆粒極度增大,光散射隨之發生變化,顆粒也會沉降,溶液的顏色變淡甚至變成無色,這一原理可定性或定量地套用於免疫反應。
5、免疫印跡技術(immunoblotting):免疫印跡是一種較新的免疫化學技術。用聚丙烯醯胺凝膠電泳將蛋白質分離,得到的區帶轉移至硝酸纖維素膜,然後用酶免疫法(或免疫螢光、RIA)進行定量。
免疫膠體金也可用於該法的定量。轉移後的硝酸纖維素膜與某特異性的抗體保溫後,再與經葡萄球菌A蛋白致敏的膠體金溫育,徹底洗去多餘的膠體金,根據膜上膠體金顆粒顏色深淺可測知樣品中的特異性抗原。
利用金顆粒可催化銀離子還原成金屬銀這一原理,採用銀顯影劑增強金顆粒的可見性,更可大大提高測定靈敏度,檢測下限可低至0.1ng,這種免疫金銀染色法套用已日趨廣泛。
由於膠體金免疫印跡技術簡便、快速,且有相當的高的靈敏度,在臨床免疫診斷上有很大的套用潛力。
6、膠體金在肉眼水平的套用
膠體金取代傳統三大標記物,用於肉眼水平的免疫檢測中。除了膠體金本身具有的特點外,還有以下優點:①試劑和樣本用量極小,樣本量可低至1~2ul;②不需γ-計數器、螢光顯微鏡、酶標檢測儀等貴重儀器,更適於現場套用;③沒有諸如放射性同位素、鄰苯二胺等有害物質參與;④實驗結果可以長期保存;⑤時間大大縮短,提高了檢測速度。金標過程中,無共價鍵形成,是一定離子濃度下的物理吸附。因此幾乎所有的大分子物質都可被金標記,標記後大分子物質活性不發生改變。實驗結果表明,膠體金的敏感性可達到ELISA的水平。而結合銀染色時,檢測的敏感性更大大提高。
注意事項
1、氯金酸易潮解,應乾燥、避光保存。
2、氯金酸對金屬有強烈的腐蝕性,因此在配製氯金酸水溶液時,不應使用金屬藥匙稱量氯金酸。
3、用於製備膠體金的蒸餾水應是雙蒸餾水或三蒸餾水,或者是高質量的去離子水。
4、是以製備膠體金的玻璃容器必須是絕對清潔的,用前應先經酸洗並用蒸餾水沖淨。最好是經矽化處理的,矽化方法可用5%二氯甲矽烷的氯仿溶液浸泡數分鐘,用蒸餾水沖淨後乾燥備用。
5、膠體金的鑑定和保存:膠體金的製備並不難,但要制好高質量的膠體金卻也並非易事。因此對每次制好的膠體金應加以檢定,主要檢查指標有顆粒大小,粒徑的均一程度及有無凝集顆粒等。
影響因素
影響膠體金溶液穩定性的主要原因是:
1、膠粒間的相互吸引力。當膠粒相距很近時,這種吸引力可能導致膠粒合併變大。
2、水化層的帶電情況。一種溶膠的各個膠粒都帶有相同的電荷。同性電荷相斥,雙電層愈厚,膠粒帶電量愈大,排斥力愈大,愈能阻止膠粒合併聚結,溶膠愈穩定。
3、膠體界面的溶劑膜,當二固體間夾有一厚層液體時,這層液體膜有一個反抗二固體接近的排斥力。兩個膠粒要進一步接近,只有克服它們之間的溶劑化膜的斥力才有可能,因此溶劑膜的斥力是使溶膠穩定的原因之一。

