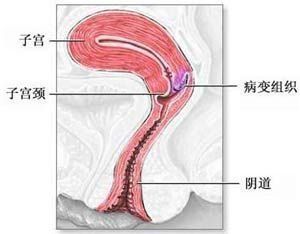
 子宮頸殘端癌
子宮頸殘端癌子宮頸殘端癌
是指子宮次全切除術後所殘留的宮頸部分發生癌變。宮頸殘端癌可在子宮次全切除術後數月至2年內發病,也可在數年或更長的時間發病。根據文獻報導和多數學者的意見,術後2年內發現宮頸殘端癌變時不能診斷為宮頸殘端癌,而切除子宮2年後發現病變才診斷為宮頸殘端癌LoneK(1992)認為子宮次全切除術後2年以內出現的宮頸殘端癌很可能是在手術時已患有宮頸癌而沒有在術前得到確診,屬於遺漏的宮頸癌。真正的宮頸殘端癌系指:子宮次全切除術時不論宮頸陰道部或頸管確無癌變存在且在術後2年新發病者,才稱為真性宮頸殘端癌。流行病學
宮頸殘端癌比較少見中國文獻報導其發病率為0.2%~1.8%。湯春生、蘇應寬(1987)LoneK(1992)報導殘端癌的發病率為1.6%中國醫學科學院腫瘤醫院1959~1992年共收治子宮頸癌14768例殘端癌82例,占0.55%宮頸殘端癌的發病年齡比普通宮頸癌晚10年,一般在40~66歲,平均年齡58歲。國外文獻報導宮頸殘端癌的發生率,差異較大占次全子宮切除術的1.3%~1.63%,占宮頸癌的0.5%~10%。國內較國外報導明顯低。
病因
 表1
表1子宮頸殘端癌是由於其他婦科病行子宮次全切除術後,引發殘留的子宮頸癌變。宮頸癌變的病因包括:
1.性行為 初次性交年齡過早多個性伴侶及男性伴侶的性行為,都被認為和宮頸癌的發生相關認為這與青春期宮頸處於鱗狀上皮化生時期,對致癌物較為敏感有關。
50多年前人們就發現在修女中宮頸癌極罕見。繼之許多研究指出婚產情況及性混亂,如初次性交過早、多個性伴侶和宮頸癌密切相關。20世紀70年代有報導宮頸癌的病死率和淋病的發病率之間有關因而認為宮頸癌大多是由性傳播疾病感染所引起的。在這些性因素中和宮頸癌關係最恆定的是性伴侶數(表1)表中列舉的是病例對照研究結果研究結果指出宮頸癌婦女較對照組婦女有更多的性伴侶,且患病的危險性直接與性伴侶數成正比。有≥10個性伴侶者較≤1個性伴侶者的相對危險性高3倍以上。事實說明多個性伴侶與CIN及宮頸癌均有明顯的相關性,但與前者的相關性更明顯。Slattery曾在一項研究中推算,性伴侶數≥10個者在宮頸癌新病例中占36%。當性伴侶數≥6個且初次性交年齡在15歲以前時則患宮頸癌的危險性上升5~10倍以上。
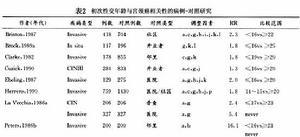 表2
表2流行病學研究還發現初次性交年齡為16歲者,其相對危險性為20歲以上的兩倍(表2)。有學者指出初婚年齡在18歲以下者,比25歲以上者的患病率高13.3倍。Biswas(1997)報導初次性交年齡在12歲以下和≥18歲者相比,OR值為3.5,且與宮頸癌的關係不依賴其他因素而獨立存在。
性關係的特徵可能也影響宮頸癌的危險性。一些學者對不同年齡階段的性伴侶數也進行了分析。Brinton(1987)及Herrero(1990)未發現20歲前的性伴侶數比終生性伴侶具有更多的意義但Peter(1986)發現終生性伴侶的作用可全部歸於20歲前多個性伴侶的作用,他還發現月經初潮及初次性交間隔時間短可提高危險性,較初次性交過早的單獨作用還強,但後人未能證實。穩定的性伴侶(時間≥3個月),較不穩定的性伴侶對宮頸癌危險的相關性更大(Brinton,1987;Herrero,1990)。這個現象提示,可能需要更長期地、重複地接觸攜帶性傳播疾病的性伴侶,其危險性才增加。Herrero(1990)發現進行肛門性交者患宮頸癌的危險性亦增加,此種相關性是真實的還是僅僅反映了雙方性行為的其他方面,還是與性衛生有關還不清楚。
2.人乳頭瘤病毒感染 人乳頭瘤病毒(human papilloma virus,HPV)感染是宮頸癌的主要危險因素。流行病學調查及臨床資料分析顯示,在發現的80餘種HPV型別中約有30餘型與性生殖道病變有關。
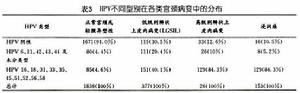 表3
表3根據HPV致病力的大小及不同CIN和宮頸癌組織中HPV感染的分布情況,HPV分為高危型和低危型兩大類。低危型多導致低度宮頸上皮內瘤變(CINⅠ)及扁平疣類病變,主要有HPV 611,30,39,42,43及44。高危型主要導致CINⅡ~Ⅲ及宮頸癌的發生,主要有HPV 16,18,31,33,35,4552,56等。表3中所示與正常宮頸及CIN相比,宮頸浸潤癌中HPV 16及18型的陽性率最高,CIN次之。而HPV 6,11型則多見於CIN中。HPV 16,18型在CINⅡⅢ級中較常見而HPV 6、11型則在CINⅠ級中多見HPV各亞型在宮頸浸潤癌中的分布如表4,以16型最多見其次為18型,45,31,33型占2%~5%。另有研究指出宮頸腺癌中以HPV 18型最常見而與鱗癌關係最大的是HPV 16型。
生殖道HPV感染主要通過性傳播,在性行為活躍的年輕女性中最常見,感染高峰年齡範圍為18~30歲。作為一種常見的性傳播疾病,HPV感染多為短暫性。大多數研究報導宮頸HPV感染的自然清除時間在7~12個月左右,只有少部分為持續感染。許多研究顯示,持續性高危型HPV感染是發生宮頸病變的必要條件。有報導稱,高危型HPV的持續性感染者患CINⅢ的風險增加100~300倍,而高危型HPV陰性者在隨後的2年內發生HGSIL(包括CINⅡ和CINⅢ)的可能性很小,隨診中細胞學結果也由輕度或交界性異常轉歸為正常。
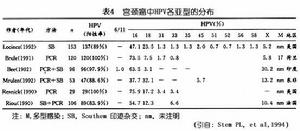 表4
表4Dalstein等(2003)報導了一項對781名宮頸細胞學為正常/ASCUS/LSIL的婦女的前瞻性研究。作者對這781名婦女套用第二代雜交捕獲法(HCⅡ)進行了高危型HPV (HR-IPV)檢測,然後每6個月隨訪1次,平均隨訪22個月。結果顯示高危型Hpv陽性患者平均感染時間為7.5個月(3~42個月),大於50%的感染者在7.5個月內清除。與高危型HPV陰性者相比,HPV短暫感染和持續感染者發生宮頸細胞學ASCUS和SlL的可能性大,其相對危險度(RR)分別為2.38和9.13,所有進展到CIN2/3以上的患者都是高危型HPV持續感染者。同時作者發現,與高危型HPV陰性者相比,高危型HPV低度到中度病毒負荷者和高度病毒負荷者更易發生宮頸細胞學異常,其相對危險度(RR)分別為1.65和8.66
Schlecht等(2001)年報導了一項前瞻性HPV持續性感染的研究結果。該研究自1993~2000年對1611名婦女進行了HPV和宮頸細胞學檢查,第1年每4個月1次隨後每年2次,將初始連續兩次HPV DNA陽性定義為持續感染。結果顯示與HPV陰性的患者相比,HPV16或18型持續感染患者發生SIL的相對危險度為8.68(95%CI,5.9~17.6);和高危型HPV陰性者相比,任何高危型HPV持續感染髮生SIL的相對危險度為10.17,而發生HSIL的相對危險度為11.6。
近30年生殖道HPV感染的發病率明顯升高,在1950~1978年間美國Rockester地區HPV感染的發病率上升了8倍,1978年為106/10萬(Chuang,1984)。1966~1984年間在美國因濕疣而就診者上升了4.5倍。
中國6省市不同地區的調查結果發現,用核酸雜交法檢測宮頸癌組織中HPV 16型DNA的陽性率為36%~64%。高發區山西省為64%,低發區四川省為36%。兩地間HPV 16的檢出率有明顯差異(章文華,1987)。司靜懿等(1992)對宮頸癌高發區新疆、華北,中發區湖北、黑龍江,低發區貴州的調查結果顯示宮頸癌中HPV 16型陽性率平均為60.4%,且各地宮頸癌中HPV16陽性率差異明顯並與各地宮頸癌的病死率水平一致。如新疆高達77%(病死率為15.78/10萬),而貴州則為45%(病死率為4.92/10萬)。進一步分析發現新疆農村宮頸癌HPV 16陽性率為88%,明顯高於城市(66%)。
在幾組病例-對照研究中,均顯示HPV感染和CIN及宮頸癌的發生密切相關。在拉丁美洲四個國家進行的一組大的病例-對照研究,包括759例宮頸浸潤癌及1467例對照用FISH法對HPV6/1116/18進行檢測,結果說明HPV 16/18和宮頸癌間有明顯的相關性。當HPV6/11及HPV 16/18均呈陽性時其相對危險性最高另外還觀察到性行為及HPV感染的作用均不依賴其他因素而獨立存在(Reeves1989)。
美國的兩組病例-對照研究(Manos,1991;Morri-son,1991)也都說明,HPV感染與CINⅠ~Ⅲ級均有很強的相關性。當多種型別的HPV感染同時存在時則危險性更高,在調整了HPV感染因素後兩組中的初次性交過早、多個性伴侶、口服避孕藥及吸菸等因素的相關性消失或明顯下降Eileen 2003年綜述文獻認為,生殖道HPV感染中存在不同類型的HPV多重感染,多重感染率可以達39%並且多重感染與病變的嚴重程度相關在大約11.8%的細胞學為正常或意義不明的不典型鱗狀細胞(ASCUS)的女性和35.4%輕到中度不典型增生的女性中,可以見到多重感染,並且其中至少有一種為高危型HPV
Schellekens等在74例宮頸癌樣本中檢測12種HPV-DNA,HPV感染率為96%,14.1%為2~3種HPV感染,其中至少有1種為高危型HPV,同時發現多重感染在腺鱗癌中較在鱗癌和腺癌中明顯多見(P=0.014)。
Morrison(1991)還指出根據雜交信號的強度推測病毒負荷增加時危險性也增加,二者間呈具統計學意義的劑量效應關係。Munonz等(1992)近年在哥倫比亞及西班牙的病例-對照研究中用三種不同的雜交法檢測HPV DNA在兩國中均顯示HPV與宮頸癌間有很強的相關性,並觀察到病毒負荷增加時宮頸癌的危險性亦上升。Josefssonzai等2000年報導了對478例宮頸原位癌和608例正常對照套用PCR技術進行HPV 16病毒負荷測定的結果他們根據病毒負荷由低到高將患者分為五組,與HPV 16陰性者相比,發生宮頸原位癌的OR值從病毒負荷低水平組到高水平組逐漸上升,分別為2.0,4.4,8.118.7,68.8。Ho等在1999年對100名女性進行隨訪,前3個月每6周隨訪1次之後每3個月隨訪1次,共15個月,將連續兩次HPV陽性定義為持續感染。HPV持續性感染與SIL的持續存在相關,其OR值為3.91(95% CI1.58~9.65),而持續性高病毒負荷的0R為4.97(95% CI,1.45~17.02)。在調整了HPV因素後,口服避孕藥、初次性交過早及教育水平低下仍與宮頸癌密切相關。
佇列研究是確定HPV和宮頸癌自然關係的理想方法Campion(1986)對100例CIN婦女長期觀察2年,每間隔8個月用FISH法檢測HPV DNA,結果HPV 16/18陽性者56%發展為CINⅢ而HPV 6陽性者僅為20%。Schneider(1987)也有相似的報告,有趣的是3例宮頸CINⅠ~Ⅱ伴HPV 16/18感染者,在其性伴侶去除了伴有HPV 16型感染之後,她們的病變也消失了。芬蘭對530例宮頸HPV陽性婦女平均隨訪60個月,以細胞異型性HPV型別作為病情惡化的觀察指標,其結果說明HPV16型較其他型別更易誘導CIN的惡化(HPV 16型有45%惡化,HPV 18型為27%,HPV 6/11各為0及13%)(Syranen,1990)。Murthy(1990)的研究結果指出63例由CIN進展為CIS的婦女,在診斷為CIS的活檢標本中HPV 16/18陽性率為68.3%,而在44例無進展的CIN婦女中,在隨訪結束時HPV 16/18陽性率為27.3%,OR為5.9,具有統計學意義。
中國醫學科學院腫瘤研究所腫瘤醫院在宮頸癌高發區山西省襄垣縣的調查研究顯示,生殖道感染高危型HPV是當地婦女宮頸癌和宮頸上皮內瘤變的主要危險因素通過對年齡為35~45歲1997例已婚婦女的調查研究,其中宮頸癌12例,CIN Ⅲ 31例,CINⅡ43例,CINⅠ127例。宮頸浸潤癌和CIN Ⅲ HPV的感染率均為100%(12/12,31/31),CINⅡ為95.3%(41/43)CINⅠ為61.4%(78/127),正常人群為14.2%(253/1784)。Bosch和Manos等通過收集來自22個國家的1008份宮頸癌活檢標本進行PCR檢測,發現93%的腫瘤中可以檢測到HPV DNA,而且各國之間無顯著差異(Bosch FX1995)。新近Manos等(Walboomers JM,1999)又重新分析了該研究中HPV陰性的病例,結合先前的數據,排除樣本量不足的因素,發現在世界範圍內宮頸癌的HPV檢出率達99.7%
綜上所述,HPV與宮頸癌的病因關係可概括如下:①上述幾組研究說明二者的相關性是強的,且為一致的;②其相關性主要表現在與少數特殊型別的病毒,即高危型病毒。
3.月經及分娩因素 有關初潮年齡、絕經年齡及衛生因素與宮頸癌的關係很少報導,Zhang等(1989)指出在中國農村(靖安縣)衛生不良(不洗外陰等)以及月經經期延長的婦女,宮頸癌的危險明顯升高;另一組調查亦發現經期產褥期衛生不良,在病例組及對照組間的RR為2.27(廖彩森1986),有顯著的統計學意義。此外,越來越多的事實說明多產和宮頸癌密切相關。我國許多省市報導分娩1~3次患病率最低(110.38/10萬),4~6次漸高(192.36/10萬),7次以上明顯增高(377.52/10萬)(楊大望1985)Brinton(1989)在拉丁美洲的調查,在調整了社會經濟因素及性因素後發現,在宮頸浸潤癌中分娩≥12胎的比分娩0~1胎者的危險性高4倍。Wang(1996)報導,我國台灣地區1991~1994年資料顯示,陰道分娩≥4次者較≤1者的患病危險性增加2倍此相關性可能為分娩對宮頸的創傷及妊娠時內分泌及營養的作用。此外還發現妊娠婦女HPV的檢出率很高很可能是妊娠期免疫功能低下促使病毒的活性增高所致。
4.男性性行為及有關因素 一些研究說明男性性行為與宮頸癌關係密切。一些學者對比了宮頸癌及健康婦女配偶的性行為及其他行為方面的特點,以研究男性在宮頸癌發病中的作用。所有這些研究均得出了一致的結論:即宮頸癌配偶的性伴侶數遠較對照組配偶的性伴侶數為多。研究還指出宮頸癌患者的配偶大多有各種性病史,包括生殖器疣、淋病、生殖器皰疹,而配偶經常用保險套的婦女則宮頸癌危險性低。對靖安縣415例宮頸癌的佇列研究結果表明,隨著初次性交年齡的提前、本人及丈夫婚外性伴侶的增加,宮頸癌的相對危險性亦上升丈夫有兩個婚外性伴侶者,其妻子宮頸癌的相對危險性上升5倍,306對配對調查(廖彩森,1986)也說明本人及配偶性混亂不論在配對調查中或高、低發區正常人群的對比調查中病例組均高於對照組,高發區高於低發區
一些學者又進一步研究了宮頸癌的危險度和配偶性行為類型的關係。在歐洲、泰國及中國台灣地區的一些研究者發現,宮頸癌的高度危險性和其配偶嫖娼的次數有關(Buckley,1981;Kjaer,1991;Wang,1996)。Reeves及Quiroz(1987)報導,在拉丁美洲男性配偶嫖娼可以影響性病的流行因此在高發區更重要的是調查上述性行為的情況最具說服力的證據是一夫一妻制的婦女患宮頸癌的危險性和她丈夫的性伴侶數直接相關(Buckley1981)。Skegg(1982)認為傳統上婚前保持貞操的婦女(印尼穆斯林)宮頸癌的發病率很高,這是因為其丈夫嫖娼而將致癌因子傳給了這些婦女所致。男性生殖器HPV感染與其配偶患宮頸癌的危險亦密切相關。Barrasso等(1987)用陰道鏡檢查了294例患宮頸扁平濕疣及186例宮頸上皮內瘤變患者的男性伴侶480例,其中64%的男性生殖器有尖銳濕疣及丘疹。宮頸上皮內瘤變患者的性伴侶中32.8%(61例)亦同時有陰莖上皮內瘤變,而扁平疣患者的性伴侶中則僅有1.4%(4例)。60例陰莖丘疹患者中60%(36例)檢測出HPV DNA序列,幾乎全部陰莖上皮內瘤變中均發現HPV 16及33型而HPV6,11及42型則只存在於濕疣中上述事實亦支持宮頸癌及其癌前病變和其男性性伴HPV感染相關的看法。
男性陰莖癌對其配偶患宮頸癌的影響亦有不少報導在中國20世紀70年代死亡回顧調查中發現,兩種癌症在地理分布上的一致性在統計學上具有非常顯著的意義(P<0.01李冰,1987)。Creham(1979)及Smith(1980)報導陰莖癌患者的妻子較其他婦女患宮頸癌的危險性高3~6倍其次前妻患宮頸癌的男性,其現在妻子患宮頸癌的危險性較對照組婦女高兩倍
男性包皮環切術與宮頸癌的關係尚無明確結論有的學者統計,包皮環切者的妻子患宮頸癌的相對危險性極低(RR 0.3)
5.吸菸 吸菸可能是宮頸癌的發病因素之一。不同的流行病學調查均顯示,吸菸者中浸潤前癌及浸潤癌的危險性均增加。在控制了其他各種因素後,發現吸菸的影響仍然存在。大多數研究中吸菸者宮頸癌的危險性增加2倍高危患者多為長期大量吸菸者,並提示有可能產生晚期效應。認為吸菸的效應只表現在鱗癌患者,而與腺癌或腺鱗癌無關。在對吸菸者宮頸黏液的檢測中發現吸菸引起的尼古丁及可鐵寧(cotinine)含量很高。有研究表明吸菸年限、每天吸菸量及初始吸菸年齡均與宮頸癌相關。雖然應考慮到吸菸對機體免疫的抑制作用,但也應考慮到其生物作用,尤其是吸菸加強了感染因素包括HPV的效應,ZurHausen(1982)認為吸菸對HPV的促癌作用需進一步研究。
6.避孕方法 口服避孕藥和宮頸癌危險度的關係受多種因素的影響,尤其是性行為的影響。大多數研究在考慮到有關因素作用後,證明其危險性仍然增加口服避孕藥≥8年者,危險性增加兩倍一些研究指出口服避孕藥者發生腺癌的危險性較高,這與描述性調查中顯示在年輕婦女中腺癌發病率增加是一致的。套用屏障避孕法(子宮帽保險套)者宮頸癌的危險性很低,推測很可能是由於減少了接觸感染的機會,子宮帽的保護作用可能部分是由於同時套用了具有抗病毒作用的精子殺滅劑。
7.皰疹病毒Ⅱ型(HSV-Ⅱ)及其他 HSV-Ⅱ是最早被認為在宮頸癌病因中起重要作用的一種病毒。中國一些單位採用多種方法進行了HSV-Ⅱ與宮頸癌的血清流行病學調查,發現宮頸癌患者中HSV-Ⅱ抗體陽性率高達80%以上而對照組則僅為14.14%~57.14%,其抗原陽性率也遠較正常對照及慢性宮頸炎者為高套用核酸原位雜交及HSV-ⅡDNA探針檢測亦發現宮頸癌組織中HSV-ⅡDNA相關序列遠較正常宮頸組織為高。此外,湖北、湖南、江西、北京等地均從宮頸癌患者宮頸刮取物中分離出HSV-Ⅱ病毒顆粒,經鑑定大多為HSV-Ⅱ型。有學者將分離的病毒株進行細胞轉化及小鼠誘發宮頸癌的研究,均獲陽性結果。以PAP法進行城市及山區(高發區)人群及宮頸癌患者宮頸脫落細胞HSV-Ⅱ抗原及血清學檢測,證明山區HSV-Ⅱ感染率高,且山區宮頸癌及癌前病變的HSV-Ⅱ抗原陽性率較當地正常人高,說明宮頸癌在HSV-Ⅱ流行地區的發病率高。進一步研究發現HSV-Ⅱ的抗體滴度在高發區明顯高於城市,同時男性血清HSV-Ⅱ抗體滴度的幾何均值兩地亦有明顯差異。有研究發現,血清HSV-Ⅱ抗體水平和宮頸癌的病死率明顯相關
國外一些研究也觀察到HSV-Ⅱ抗體陽性的婦女中,CINCIS及浸潤癌均較正常婦女為高,且HSV-Ⅱ與宮頸浸潤癌的相關性較CIN為強。美國的兩組研究(Graham,1982;Thomas,1978)在調整了其他混雜因素影響後,仍然顯示出HSV-Ⅱ抗體陽性者患CIS及浸潤癌的危險性均增高。另一項對2.3萬婦女的病例-對照研究顯示,在HSV-Ⅱ抗體陽性的婦女中宮頸癌的危險性上升兩倍(Choi,1977),但Vonka(1984)及Adam(1985)的兩組相似的研究則未能證明其相關性Armstrong(1986)觀察到HSV-Ⅱ感染與性傳播疾病門診的年輕婦女的CIN呈短暫正相關,但用細胞學方法檢查則未證實其相關性,在丹麥及格陵蘭婦女中,隨機取樣的調研結果顯示格陵蘭(宮頸癌發病率較丹麥高6倍)婦女中HSV-Ⅱ抗體的陽性率較丹麥高。
綜上所述,雖然HSV-Ⅱ與宮頸癌的病因聯繫不能肯定,但亦不能排除,尤其是可能與HPV之間的相互作用Hildesheim等(1991年)發現HSV-Ⅱ與HPV有協同作用與此兩種病毒均陰性者比較,HSV-Ⅱ陽性者的RR為1.2,HPV 16/18陽性者的RR為4.3,而當HSV-Ⅱ及HPV 16/18均陽性時則RR為8.8。孟祥金等(1989)分別用DNA雜交法及PAP法,對50例慢性宮頸炎、CIN及宮頸癌的HPV DNA及HSV-Ⅱ抗原同時進行檢測,在部分病例中兩種病毒同時存在,提示二者間可能存在某些聯繫
其他和宮頸癌有關的性傳播疾病如梅毒、淋病、滴蟲病、沙眼等均曾有報導但也有相反的結果。有學者在宮頸癌及對照組中對5種感染性疾病HPV、HSV-Ⅰ、Ⅱ、HCMV、EB病毒及衣原體感染進行了檢測分析,發現HPV、HSV、HCMV、衣原體感染和宮頸癌都有很強的相關性,當感染的種類增加時危險性亦隨之增高,35.5%的患者有4種或4種以上感染,而對照組則無。
發病機制
宮頸殘端呈不同程度糜爛,見贅生物呈菜花狀、結節狀、潰瘍或形成空洞,宮旁組織增厚、呈結節狀等。
由於子宮次全切除後殘留的宮頸仍保持原有的淋巴引流,因此宮頸殘端癌的擴散方式亦和一般宮頸癌一樣,可向宮頸旁延伸至盆壁組織而導致腰酸、下腹不適等症狀。腫瘤可沿宮頸旁淋巴結轉移至盆腔和遠處淋巴結。癌瘤向前方浸潤,膀胱受累可有尿頻、尿痛、尿血等症狀,向後擴散侵犯直腸出現排便不暢、里急後重、下墜和便血等症狀。
臨床表現
 症狀
症狀國內江森等(1992)報導的宮頸殘端癌,10例臨床分析發病距前次手術的時間:<5年1例,5~9年4例,10~15年3例>15年2例。張蓉(1997)報導了12例子宮頸殘端癌的治療,分析其發病距前次手術時間為3個月~27年;其中<3年3例,3~5年2例,>10年7例
臨床症狀和體徵可因臨床分期和腫瘤生長方式的不同而異。宮頸殘端癌的早期癌病例有時可無症狀,約占6%。只是普查或因其他原因檢查時才被發現。宮頸殘端浸潤癌患者一般可有陰道不規則出血及陰道分泌物增多,主要症狀和宮頸癌完全一樣有學者報導宮頸殘端癌患者,75%~80%有陰道流血,10%~14%有白帶增多如果腫瘤繼發感染、組織壞死,分泌物可伴有惡臭,以及腰痛、小腹下墜等症狀
1.臨床分期 宮頸癌的臨床分期已有70多年的歷史,歷經數次修改、逐步完善開始時將腫瘤浸潤到盆壁即“冰凍骨盆”列為Ⅳ期,在1937年修改分期時定為Ⅲ期;1950年修改分期時決定將宮體受侵不作為分期的標準(原分期宮體受侵定為Ⅱ期);1961年的分期標準明確0期癌為原位癌、上皮內癌,並指出0期癌病例不包括在任何治療統計中。1970、1985年又有了隱匿癌(OCC)的概念,以及在Ⅲ期中增加了腎盂積水或腎無功能。以後又將0期和Ⅳ期的標準做了說明等2003年在聖地亞哥(智利)召開的FI-GO會議上,又對Ⅰ期的分期標準進行了修訂。此次修訂後的宮頸癌臨床分期標準即為國際統一使用的分期標準,內容見圖1:
0期:原位癌、上皮內癌(此期病例不列入任何治療統計中)。
Ⅰ期:病變局限於宮頸(宮體是否受累不予考慮)。
Ⅰa期:僅在顯微鏡下鑑別的浸潤癌。肉眼所能見到的病變,即使淺表浸潤,也屬Ⅰb期;間質浸潤的深度<5mm寬度<7mm(浸潤深度從腫瘤部位上皮或腺體基底膜向下<5mm),靜脈或淋巴管區的浸潤不改變分期。
Ⅰa1期:間質浸潤深度<3mm,寬度<7mm。
Ⅰa2期:間質浸潤深度為3~5mm寬度<7mm。
Ⅰb期:臨床檢查病變局限於宮頸或臨床前病變大於Ⅰa期。
Ⅰb1期:臨床可見病變直徑<4cm。
Ⅰb2期:臨床可見病變直徑>4cm。
Ⅱ期:病變超出宮頸,但未至盆壁,陰道浸潤未到陰道下1/3。
Ⅱa期:無明顯宮旁浸潤
Ⅱb期:有明顯宮旁浸潤。
Ⅲ期:病變浸潤達盆壁,直腸檢查時腫瘤與盆壁間無間隙;癌累及陰道下1/3;無其他原因的腎盂積水或腎無功能。
Ⅲa期:病變未達盆壁,但累及陰道下1/3。
Ⅲb期:病變已達盆壁或有腎盂積水或腎無功能。
Ⅳ期:病變已超出真骨盆或臨床已浸潤膀胱或直腸黏膜。
Ⅳa期:病變擴散至鄰近器官。
Ⅳb期:病變轉移至遠處器官
2.分期注意事項
(1)0期包括上皮全層均有不典型細胞,但無間質浸潤者。
(2)Ⅰa(Ⅰa1及Ⅰa2)期診斷必須根據顯微鏡下的觀察確定。
(3)Ⅲ期的診斷應為宮旁浸潤達盆壁、腫瘤與盆壁間無間隙,而且增厚為結節狀時,方能確定。
(4)即使根據其他檢查定為Ⅰ或Ⅱ期但有癌性輸尿管狹窄而產生腎盂積水或腎無功能時,亦應列為Ⅲ期。
(5)膀胱泡樣水腫不能列為Ⅳ期膀胱鏡檢查見到隆起及溝裂並在同時通過陰道或直腸能確診證實該隆起或溝裂與腫瘤固定時應視為膀胱黏膜下受侵,膀胱沖洗液有惡性細胞時,應在膀胱壁取活體組織病理檢查證實。
併發症:
合併感染、周圍組織粘連、復發
診斷
根據症狀和體徵、臨床檢查及病理診斷宮頸殘端癌並不困難,診斷和一般宮頸癌的診斷相同。有的學者認為宮頸殘端癌診斷時的期別要比一般宮頸癌診斷時的期別要晚,但也有學者認為,由於子宮次全切除術後出現陰道出血比沒有手術者更能引起患者的注意,因此早期病例占多數。宮頸殘端癌由於切除了子宮體及前次手術造成的解剖學改變以及可能出現的併發症使治療較為困難,因此早期診斷尤為重要。
鑑別診斷
應注意與宮頸、陰道炎性疾病相鑑別。
檢查
 檢查
檢查實驗室檢查
1.宮頸刮片細胞學檢查 普遍用於宮頸癌篩查。必須在宮頸移行區刮片檢查,主要依據細胞核變化判斷細胞惡性
2.碘試驗 碘試驗對癌無特異性,利用正常宮頸上皮富含糖原會被碘染成棕黑色,而癌上皮缺乏糖原,碘染不著色。在不著色區域取活組織,提高診斷準確率。
其它輔助檢查:
1.陰道鏡檢查 觀察宮頸表面有無異型上皮或早期癌變,並選擇病變部位進行活組織檢查,以提高診斷準確率。
2.宮頸和宮頸管活組織檢查 是確診宮頸癌及其癌前病變最可靠和不可缺少的方法。
治療
 子宮頸殘端癌
子宮頸殘端癌宮頸殘端癌的治療方法與一般宮頸癌相同,以手術、放療為主,晚期病例則採取手術、放療及化療的綜合治療,治療效果與放化療前臨床分期、組織病理形態、腫瘤生長方式及患者的全身狀況有關。
由於子宮體已切除,膀胱、直腸和宮頸殘端粘連,加之周圍形成的粘連灶和瘢痕,都給治療帶來了困難。
手術治療適用於早期宮頸殘端癌。術中要特別注意解剖關係防止及減少併發症(江森,1992)。如果手術切除不滿意,可以術後給予放射治療以提高療效,但可能出現一些併發症。Petersen(1992)報導3例早期病例(Ⅰa、Ⅰb、Ⅱa)接受宮頸切除術,但未行淋巴結清掃,其中2例術後行體外照射和腔內治療,均無復發
多數ⅡⅢ期宮頸殘端癌患者和普通宮頸癌一樣採用放射治療,腔內治療仍然是殘端癌放射治療的重要組成部分。但由於宮體已切除,頸管縮短導致腔內照射的總劑量減少增加了局部復發的可能性。如果提高腔內治療的劑量,則可使生存率達到普通宮頸癌的水平,但放射性直腸炎和膀胱炎的發病率相應增高Petersen(1992)在分析43例宮頸殘端癌的放療時指出:殘端癌的發生率低,治療較普通宮頸癌困難,手術難度大絕大多數病人選擇放療,但放療的併發症較一般宮頸癌高。因此,有必要考慮用不同的放療方法降低併發症的發生率。孫建衡(1992)在總結子宮頸癌後裝治療5年的經驗時指出,適當減少腔內放射次數,採取部分全盆照射,可降低放療的併發症。張蓉(1997)分析12例宮頸殘端癌的治療,其中9例患者接受了體外全盆照射腫瘤劑量2000~4000cGy,腔內後裝治療3~5次,A點劑量6~23Gy其中1例死於其他原因,2例死於腫瘤,存活率與普通宮頸癌相同,且無嚴重的併發症發生。
中國醫學科學院腫瘤醫院放射治療宮頸殘端癌,注重體外照射的作用。全盆照射劑量可在3000~5000cGy之間選擇,同時腔內後裝治療,可採用組織內插植和陰道容器消除宮頸的大體積腫瘤。如果宮頸管殘留長度為2.5~3cm,則可增加腔內治療劑量有利於局部腫瘤的控制,但要減少體外全盆照射劑量。體外照射劑量可根據腔內治療的情況增加或減少,但總的A點劑量可在6000~7000cGy之間調整。
預後預防
 子宮
子宮預後:
依據病變擴散的範圍和臨床分期宮頸殘端癌的預後與普通宮頸癌基本相同Petersen(1992)報導28例宮頸殘端癌體外加腔內放療5年存活率為62%;張蓉(1997)報導體外照射加腔內後裝治療9例,存活6例存活率66.7%因此腔內後裝治療與體外照射相結合可以獲得較好的治療效果然而Wolff等認為隱性癌的預後較差,因為病情進展快,轉移率高。Peterson(1992)報導28例5年存活率為62%,總之,臨床分期和治療方案對預後的影響頗大。
預防:
為了減少宮頸殘端癌的發生,在決定行子宮次全切除或全子宮切除術之前必須嚴格檢查排除宮頸癌。在行次全子宮切除術後,患者應定期參加普查,而早期診斷、及時適當的治療對殘端癌更為重要。次全子宮切除術後應定期檢查如常規做宮頸防癌塗片檢查,必要時做固有螢光光譜診斷陰道鏡檢查及宮頸活組織檢查等排除惡變,以免漏診。次全子宮切除後若患者主訴陰道流血應及早診治。患者治療後,還應定期按常規隨訪,如有復發應積極進行治療