介紹
G蛋白是細胞內信號傳導途徑中起著重要作用的GTP結合蛋白,由α,β
 G蛋白偶聯受體示意圖
G蛋白偶聯受體示意圖,γ三個不同亞基組成。激素與激素受體結合誘導GTP跟G蛋白結合的GDP進行交換結果激活位於信號傳導途徑中下游的腺苷酸環化酶。G蛋白將細胞外的第一信使腎上腺素等激素和細胞內的腺苷酸環化酶催化的腺苷酸環化生成的第二信使cAMP聯繫起來。G蛋白具有內源GTP酶活性。
細胞間通過傳遞信號分子相互交流。有些信號分子可以通過血液在體內進行遠距離傳輸;另一些在鄰近細胞間傳遞。人體中存在成千上萬種信號分子,常見的如控制興奮水平的腎上腺素,傳遞血糖水平的高血糖素,標誌組織損傷的組胺和在神經系統中傳遞信息的多巴胺。
讀取信息
細胞間通過傳遞信號分子相互交流。有些信號分子可以通過血液在體內進行遠距離傳輸;另一些在鄰近細胞間傳遞。人體中存在成千上萬種信號分子,常見的如控制興奮水平的腎上腺素,傳遞血糖水平的高血糖素,標誌組織損傷的組胺和在神經系統中傳遞信息的多巴胺。
一般情況下,信號分子與細胞表面的受體結合,然後,由以G蛋白為核心的信號傳遞系統把信息從胞外傳遞到胞內。G蛋白系統是細胞中最常見的信號傳遞方式。細胞中存在數以千計的特異性G蛋白偶聯受體:有些識別激素,改變新陳代謝的水平;有些在神經系統中傳遞神經信號。我們的視覺依賴於一種光敏G蛋白系統;而我們的嗅覺則由上千種形式各異的受體控制,它們有各自專一識別的氣味分子。受體和G蛋白共同完成信號傳導過程。
蛋白分類
G蛋白的種類已多達40餘種,大多數存在於細胞膜上,由α、β、γ三個不同亞單位構成,總分子量為100kDa左右。其中β亞單位在多數G蛋白中都非常類似,分子量36kDa左右。γ亞單位分子量在8-11kDa之間,除Gt外,大多數G蛋白的γ亞單位都是相同的。βγ兩個亞單位的不同可以將G蛋白分為Gs、Gi、Go、Gq、G?及Gt等六類。這些不同類型的G蛋白在信號傳遞過程各種發揮不同的作用。除此之外,在細胞內還存在另一類G蛋白,這類G蛋白具有鳥核苷酸的結合位點,有GTP酶活性,其功能也受鳥核苷酸調節,但與跨膜信息傳遞似乎沒有直接相關。在結構上不同於前述的G蛋白,分子量較小,在20-30kDa之間,不是以α、β、γ三聚體方式存在,而是單體分子,因此被稱為小G蛋白(small G proteins)。如ras表達產物為一種小G蛋白。小G蛋白同ras蛋白具有同源性,同屬於ras超家族(ras superfamily)。哺乳動物G蛋白中屬ras超家族約有50多個成員,根據它們序列同源性相近程度又可以分為Ras、Rho和Rab三個主要的亞家族。
蛋白調控
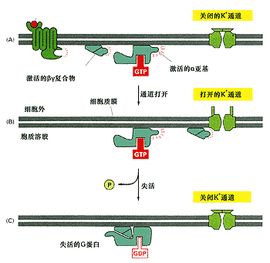
G蛋白在信號轉導過程中起著分子開關的作用。與GDP(紫色)結合後,G蛋白處於非活性狀態。GTP取代GDP後,G蛋白活化並傳遞信號。G蛋白形式多樣,大多數用於信號傳遞,有些則在諸如蛋白質合成中起重要作用。本文主要介紹異三聚體G蛋白,它由三條不同的鏈組成,分別為α(棕黃色)β(藍色)γ(綠色)。紅色部分是α亞基表面的一個環狀結構,在信號傳遞中至關重要。
細胞膜
附著於G蛋白鏈的一些小分子類脂(圖右上部),嵌入細胞膜,使G蛋白結合於細胞內膜表面,與受體接近。蛋白質結晶時這些類脂被除去,因此晶體結構中不顯示。
攻擊
G蛋白系統是許多信號傳遞途徑的中心環節,因此也就成了眾多藥物和毒素攻擊的靶位點。市面上的很多藥物,如Claritin和Prozac,以及大量濫用的毒品:古柯鹼,海洛因,大麻等,通過與G蛋白偶聯進入細胞發揮其藥性。霍亂菌產生一種毒素,與G蛋白處在關鍵位置的核苷結合,使G蛋白處於持續活化狀態,破壞腸細胞液體平衡的正常調控。感染者因身體喪失水,鈉和氯化物而脫水。
信號接力G蛋白位於細胞膜內表面。當受體同激素或神經遞質結合後,信息傳遞過程起始。如結合腎上腺素後,受體首先改變形狀,與細胞內非活性狀態的G蛋白結合。這種結合使G蛋白放棄GDP,接受GTP。 GTP使一個小的環狀結構變形,G蛋白分解成兩部分——其中攜帶GTP的α亞基沿膜移動直至遇到腺苷酸環化酶,小的環狀結構與腺苷酸環化酶結合併將其激活。活化後的腺苷酸環化酶產生大量cAMP(環腺苷酸)分散到細胞內——傳達信息。最終,GTP水解成GDP,G蛋白重新組裝,恢復非活性狀態。
這種信號傳遞途徑的最大優點是使信號加強。與信號傳遞鏈中的酶(如腺苷酸環化酶)結合後,細胞外微弱的信號在胞內被轉換成強信號。在前面的例子中,僅一個腎上腺素分子就可以激生大量的cAMP.
結構探索GTP是G蛋白活性狀態的開關。在活性狀態,GTP的最後一個磷酸基團與G蛋白表面的環狀結構相連,使環處於緊密狀態。當GTP水解成GDP時,這個磷酸基被移去,GDP變短不能與此環相連,導致環結構鬆散,轉變為非活性三聚體,如圖左蛋白質編碼1gg2。
β亞基同樣值得花時間研究,如蛋白質編碼1gg2, 1got 和1tbg。如果沿著它的的跡線繪一條帶狀圖,你會發現這是一個美妙的螺鏇槳狀結構。
傳遞
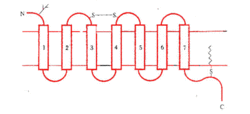
細胞表面的受體通過與其相應配體作用後,可經不同種類的G蛋白偶聯,分別發揮不同的生物學效應。與G蛋白偶聯的多種受體具有共同的結構功能特點:分子量40-50kDa左右,由350-500胺基酸組組成,形成7個由疏水胺基酸組成的α螺鏇區段,反覆7次穿越細胞膜的脂質雙層。肽鏈的N末端在胞膜外,C末端在細胞內。N末端上常有許多糖基修飾。從功能上看,受體的識別區域並不象一般想像的那樣在胞膜的外部,實際上是由7個跨膜區段間通過特定胺基酸殘基之間的相互作用形成複雜的空間構象。配體結合於識別區域之後,即導致整個受體構象的變化。受體肽鏈的C末端和連線第5和第6個跨膜區段的第三個胞內環是G蛋白結合部位。目前研究發現,趨化因子受體家族(chemokine receptor family)以及一些神經遞質受體都屬於G蛋白偶聯的7次跨膜受體的超家族。例如IL-8RA胞膜外N端Asp11、Llu275、Arg280以及可形成二硫鍵的Cys30和Cys277在與配體結合中起重要作用;緊接第三個空膜區第二個胞漿環中DRY序列對於與G蛋白的結合是必要的。
(1)Gs:細胞表面受體與Gs(stimulating adenylate cyclase g protein,Gs)偶聯激活腺苷酸環化酶,產生cAMP第二信使,繼而激活cAMP依賴的蛋白激酶。
(2)Gi:細胞表面受體同Gi(inhibitory adenylate cyclase g protein,Gi)偶聯則產生與Gs相反的生物學效應。
(3)Gt:可以激活cGMP磷酸二酯酶,同視覺有關。
(4)Go:可以產生百日咳桿菌毒素導致的一系列效應。
(5)Gq:同PLC偶聯,在磷脂醯肌醇代謝途徑信號傳遞過程中發揮重要作用。
(6)小G蛋白:近年來研究發現小G蛋白,特別是一些原癌基因表達產物有著廣泛的調節功能。Ras蛋白主要參與細胞增殖和信號轉導;Rho蛋白對細胞骨架網路的構成發揮調節作用;Rab蛋白則參與調控細胞內膜交通(membrane traffic)。此外,Rho和Rab亞家庭可能分別參與淋巴細胞極化(polarization)和抗原的提呈。某些信號蛋白通過SH-3功能區將酪氨酸激酶途徑同一些由小G蛋白所控制的途徑連線起來,如Rho(與Ras有30%同源性)調節胞漿中微絲上肌動蛋白的聚合或解離,從而影響細胞形態。這一事實解釋了某些含有SH-3的蛋白同細胞骨架某些成份相關聯或調節它們的功能。
G-蛋白概念
 G-蛋白概念的市場關注
G-蛋白概念的市場關注2012年諾貝爾化學獎授予了兩名美國科學家羅伯特·萊夫科維茨與布賴恩·科比爾卡,以獎勵他們在G蛋白偶聯受體領域做出的卓越貢獻。
據此,G蛋白偶聯受體才被公眾所知曉。在11日舉行的2013年皇后鎮分子生物學(上海)會議上,中美科學家聯手成功解析了世界上首個B型G蛋白偶聯受體,這有望為2型糖尿病等多種代謝疾病帶來更多的新藥物。