概述
轉染(transfection)採用與質粒DNA轉化受體細胞相似的方法,即宿主菌先經過CaCl2,電穿孔等處理成感受態細菌,再將重組噬菌體DNA直接導入受體細胞,進入感受態細菌的噬菌體DNA可以同樣複製和繁殖,這種方式稱為轉染。轉染是轉化的一種特殊形式。
常規轉染技術可分為兩大類,一類是瞬時轉染,一類是穩定轉染(永久轉染)。前者外源DNA/RNA不整合到宿主染色體中,因此一個宿主細胞中可存在多個拷貝數,產生高水平的表達,但通常只持續幾天,多用於啟動子和其它調控元件的分析。一般來說,超螺鏇質粒DNA轉染效率較高,在轉染後24-72小時內(依賴於各種不同的構建)分析結果,常常用到一些報告系統如螢光蛋白,β半乳糖苷酶等來幫助檢測。後者也稱穩定轉染,外源DNA既可以整合到宿主染色體中,也可能作為一種游離體(episome)存在。儘管線性DNA比超螺鏇DNA轉入量低但整合率高。外源DNA整合到染色體中機率很小,大約1/104轉染細胞能整合,通常需要通過一些選擇性標記,如來氨丙基轉移酶(APH;新黴素抗性基因),潮黴素B磷酸轉移酶(HPH),胸苷激酶(TK)等反覆篩選,得到穩定轉染的同源細胞系。
分類
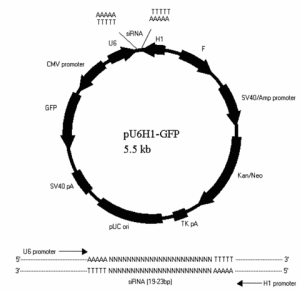 轉染
轉染化學轉染法包括:1.DEAE-葡聚糖法,2.磷酸鈣法,3.人工脂質體法。DEAE葡聚是最早套用哺乳動物細胞轉染試劑之一,DEAE-葡聚糖是陽離子多聚物,它與帶負電的核酸結合後接近細胞膜而被攝取,用DEAE-葡聚糖轉染成功地用用於瞬時表達的研究,但用於穩定轉染卻不是十分可靠。磷酸鈣法是磷酸鈣共沉澱轉染法,因為試劑易取得,價格便宜而被廣泛用於瞬時轉染和穩定轉染的研究,先將DNA和氯化鈣混合,然後加入到PBS中慢慢形成DNA磷酸鈣沉澱,最後把含有沉澱的混懸液加到培養的細胞上,通過細胞胞膜的內吞作用攝入DNA。磷酸鈣似乎還通過抑制血清中和細胞內的核酸酶活性而保護外源DNA免受降解.人工脂質體法採用陽離子脂質
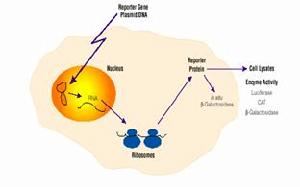 轉染
轉染物理方法包括:①顯微注射②電穿孔③基因槍等,顯微注射雖然費力,但是非常有效的將核酸導入細胞或細胞核的方法。這種方法常用來製備轉基因動物,但卻不適用於需要大量轉染細胞的研究。電穿孔法常用來轉染如植物原生質體這樣的常規方法不容易轉染的細胞。電穿孔靠脈衝電流在細胞膜上打孔而將核酸導入細胞內。導入的效率與脈衝的強度和持續時間有關係,基因槍依靠攜帶了核酸的高速粒子而將核酸導入細胞內,這種方法適用於培養的細胞核在體的細胞.
細胞轉染實驗
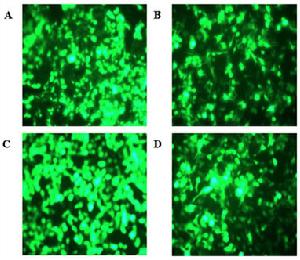
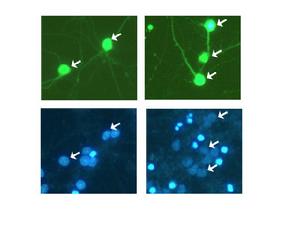 轉染實驗顯微圖
轉染實驗顯微圖學習和掌握外源基因導入真核細胞的主要方法—脂質體介導的轉染。了解外源基因進入的一般性方法,觀測外源蛋白的表達(綠色螢光蛋白),為染色準備實驗材料。
實驗原理
外源基因進入細胞主要有四種方法:電擊法、磷酸鈣法和脂質體介導法和病毒介導法。電擊法是在細胞上短時間暫時性的穿孔讓外源質粒進入;磷酸鈣法和脂質體法是利用不同的載體物質攜帶質粒通過直接穿膜或者膜融合的方法使得外源基因進入細胞;病毒法是利用包裝了外源基因的病毒感染細胞的方法使得其進入細胞。但是由於電擊法和磷酸鈣法的實驗條件控制較嚴、難度較大;病毒法的前期準備較複雜、而且可能對於細胞有較大影響;所以現在對於很多普通細胞系,一般的瞬時轉染方法多採用脂質體法。
利用脂質體轉染法最重要的就是防止其毒性,因此脂質體與質粒的比例,細胞密度以及轉染的時間長短和培養基中血清的含量都是影響轉染效率的重要問題,通過實驗摸索的合適轉染條件對於效率的提高有巨大的作用。
本次實驗採用的脂質體是promega公司的TransFast脂質體試劑,它是一種陽離子脂質體和中性脂質體的混合物,是對於本次實驗中採用的293T細胞最佳化的轉染試劑。"
實驗材料與器材
(1)材料
293T細胞、MyoD表達質粒和EGFP表達質粒、DMEM培養基、鏈黴素/青黴素(雙抗)、FCS(小牛血清)、PBS(磷酸鹽緩衝溶液)、胰酶/EDTA消化液、轉染試劑(TransFast)
(2)器材
20ul/200ul/1ml微量移液器和Tip頭酒精燈、廢液缸、血球計數板、渦鏇振盪器、恆溫水浴箱、台式離心機、35mm培養皿、轉染管、15ml離心管、觀察用倒置顯微鏡螢光顯微鏡和CCD
實驗步驟
細胞傳代
(1)試驗準備:200ul/1mlTip頭各一盒(以上物品均需高壓滅菌),酒精棉球,廢液缸,試管架,微量移液器,記號筆,培養皿,離心管。
(2)棄掉培養皿中的培養基,用1ml的PBS溶液洗滌兩次。
(3)用Tip頭加入1mlTrypsin液,消化1分鐘(37。C,5%CO2)。用手輕拍培養瓶壁,觀察到細胞完全從壁上脫落下來為止。
(4)加入1ml的含血清培養基終止反應。
(5)用Tip頭多次吹吸,使細胞完全分散開。
(6)將培養液裝入離心管中,1000rpm離心5min。
(7)用培養液重懸細胞,細胞計數後選擇0.8X106個細胞加入一個35mm培養皿。
(8)將合適體積完全培養液加入離心管中,混勻細胞後輕輕加入培養皿中,使其均勻分布。
(9)將培養皿轉入CO2培養箱中培養,第二天轉染。
細胞轉染
1)轉染試劑的準備
A.將400ul去核酸酶水加入管中,震盪10秒鐘,溶解脂狀物。
B.震盪後將試劑放在-20攝氏度保存,使用前還需震盪,。
2)選擇合適的混合比例(1:1-1:2/脂質體體積:DNA質量)來轉染細胞。在一個轉染管中加入合適體積的無血清培養基。加入合適質量的MyoD或者EGFP的DNA,震盪後在加入合適體積的轉染試劑,再次震盪。
5)將混合液在室溫放置10—15分鐘。
6)吸去培養板中的培養基,用PBS或者無血清培養基清洗一次。
7)加入混合液,將細胞放回培養箱中培養一個小時。
8)到時後,根據細胞種類決定是否移除混合液,之後加入完全培養基繼續培養24-48小時。
第二次細胞傳代
1)在轉染後24小時,觀察實驗結果並記錄綠色螢光蛋白表達情況。
2)再次進行細胞傳代,按照免疫染色合適的密度0.8X105個細胞/35mm培養皿將細胞重新粉入培養皿中。
3)在正常條件下培養24小時後按照染色要求條件固定。
研究進展
 轉染管
轉染管線型PEI(LinePEI,LPEI)與其衍生物用作基因轉染載體的研究比分枝狀PEI(BranchedPEI,BPEI)要早一些,過去的研究認為在不考慮具體條件,LPEI/DNA轉染複合物的細胞毒性較低,有利於細胞定位,因此與BPEI相比應該轉染效率高一些。但最近研究表明BPEI的分枝度高有利於形成小的轉染複合物,從而提高轉染效率,但同時細胞毒性也增大。超高分枝的、較柔性的PEI衍生物含有額外的仲胺基和叔胺基,在染實驗中發現這種PEI的毒性低,但轉染效率卻較高。
GenEscort是採用各種分枝狀和超高分枝狀的小分子PEI與各種含有生理條件下可降解鍵的交聯劑交聯,合成出的一系列高分枝的可降解的PEI衍生物。聚合物的分枝結構使得其具有較高的正電性,因此易於高效地包裹各種DNA、RNA分子及質粒形成小的納米顆粒,從而提高轉染效率,當所形成複合物進入細胞以後,其中所含的生理條件下可降解的化學鍵在細胞內水解,使交聯聚合物分解為無細胞毒性的小分子PEI,這樣結構的轉染試劑在體外套用可以獲得高的轉染效率和低的細胞毒性,其可降解性對體內套用也具有重要的意義。