簡介
基因轉染技術就是將純化的含有靶基因的質粒DNA送入細胞內,並在細胞內表達。
基因轉染技術已廣泛套用於基因組功能研究和基因治療研究。
轉染方法
轉染
轉染指通過生化或者物理方法將目的基因導入真核細胞中。
感染
感染指通過病毒介導,用基因組中攜帶有克隆目的片斷的病毒來感染靶細胞。
基因運載系統
將某一特定的靶基因傳遞到靶細胞,需要套用某一基因運載系統,這一系統可概括為兩大類:非病毒方法和病毒方法
非病毒方法
非病毒方法包括以下幾種方法:
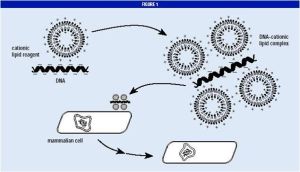 陽離子脂質體介導的轉染
陽離子脂質體介導的轉染 1、化學轉染法
(1)DEAE-葡聚糖和polybrene聚陽離子法:帶正電的DEAE-葡聚糖或polybrene多聚體複合物和帶負電的DNA分子使得DNA可以結合在細胞表面。通過使用DMSO或甘油獲得的滲透休克將DNA複合體導入。DEAE-葡聚糖僅限於瞬時轉染。
(2)磷酸鈣共沉澱法:將氯化鈣、DNA和磷酸鹽緩衝液混合,形成磷酸鈣微沉澱,附著於細胞膜並經過細胞內吞作用進入細胞質。
該方法的轉化效率通常很低。
(3)脂質體染法:脂質體能在體內或體外提供運載外源性遺傳物質進入細胞的載體。脂質體介導的基因轉移的最大優勢在於能在活體內套用。
2、生物方法
(1)直接注射法:將含有DNA的溶液直接注射到肌肉,以引起鄰近的細胞攝入DNA鏈進行表達,在肌細胞中,基因表達可持續數月。
(2)受體介導的基因轉移:依靠受體介導的細胞內吞途徑以轉移外源基因。受體介導的基因轉移方法是在質粒DNA和某種特異的多肽(配體)之間形成複合體,而這種多肽能為細胞表面的受體所識別。如若將DNA在體內運送至肝內,可以選將DNA和能與肝細胞受體特異結合的去唾液酸糖蛋白質偶聯,以便通過細胞內吞過程而被攝入,這種DNA大部分被肝臟所攝取。套用該方法轉移的外源基因在活體內的表達持續時間較短,在評估實際套用前景上還存在一些問題。
(3)精子載體法:用精子和NDA(吡啶核甘酸輔酶)-劑孵育,可捕獲得DNA。通過受精過程,將外源性基因導入受精卵,大大簡化了轉基因動物的製備過程。這項轉染方法是才發展出來套用在魚類轉殖的最新技術,它最大有點就是簡單方便。
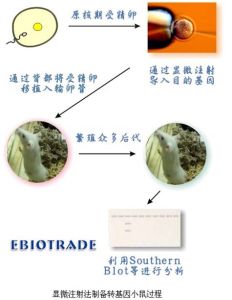 顯微注射法
顯微注射法3、物理方法
(1)微粒子轟擊法(基因槍):在真空狀態下,利用粒子加速器將外面包裹了外源基因DNA的金顆粒或鎢粉微顆粒進行加速,打入完整的細胞中,從而使外源基因DNA得以在靶細胞中穩定轉化並有可能獲得表達。實驗結果表明,用這種方法靶基因可在皮膚、肌肉、肝、胰、胃和乳腺等細胞中表達。
(2)顯微注射法:在顯微鏡下,將DNA經同細胞玻璃針直接注入細胞,該法適合於各種培養生長的細胞,但需要一定的設備和操作技巧。
(3)電穿孔法:電穿孔通過將細胞暴露在短暫的高場強電脈衝中轉導分子。即利用脈衝場將DNA導入培養細胞。電脈衝和場強的最佳化對於成功的轉染很重要。
病毒方法
病毒作為基因轉染是基因遞送良好的工具,病毒載體的優點有:
(1)在轉化的細胞中傳播重組的DNA分子作為穩定的遺傳成分;
(2)可能將有缺陷的或突變的基因置於病毒調節信號的控制下以進行研究;
(3)能將克隆的基因作為病毒微染色體的一部分,並能進行分離;
(4)轉移效率較高。其主要缺點是病毒載體對外源基因的最大容納量只有2500bp。
常用的病毒載體有下列幾種:
1、逆轉錄病毒載體
逆轉錄病毒為RNA病毒,它們的基因組編碼在一條單鏈RNA上,病毒進入細胞通過逆轉錄作用,病毒RNA即轉變為雙鏈DNA分子,DNA進入細胞核並整合在細胞染色體中,這種整合的病毒稱為原病毒。在原病毒的兩端各有一長末端重複序列(LTR),LTR內側還有為複製所必需的其他順序,包括包裝信號。常用的逆轉病毒載體有CMV和SV。
2、DNA病毒載體
主要有腺病毒相關病毒載體,皰疹病毒載體。這一類是利用病毒載體介導的基因轉移,以其高轉染率和良好的靶向性成為腫瘤基因治療的有效方法。對DNA病毒載體的研究是基因治療研究中的重點領域。
基本過程
靶細胞的準備
被用於作靶基因轉染的細胞,其生長狀態如何,將直接決定了基因轉染效率。如為貼壁生長的細胞,一般要求在轉染前一日,必需套用胰酶處理成單細胞懸液,重新接種於培養皿或瓶,細胞密度以鋪滿培養器皿的60%為宜,轉染當日,在轉染前4小時換一將近新鮮培養液。對於懸浮細胞,也需在轉染前4小時換一次新鮮培養液。
靶基因質粒DNA的準備
用於轉染的質粒DNA必須無蛋白質,無RNA和其它化學物質的污染,OD260/280比值應在1.8以上。DNA的質量和純度能影響某些細胞系的轉染效率,可以通過CsCl梯度法或標準柱層析法進行純化。
轉染與分析
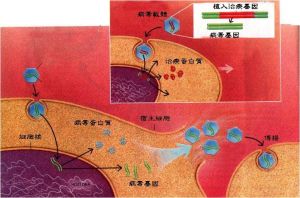 病毒載體轉染過程
病毒載體轉染過程具體的基因轉染條件應參考所使用的試劑和方法進行最佳化。靶基因被導入細胞後,一般在轉染後48小時,靶基因即在細胞內表達。根據不同的實驗目的,48小時後即可進行靶基因表達的檢測等實驗。如若建立穩定的細胞系,則可對靶細胞進行篩選,根據不同基因載體中所含有的抗性標誌選用相應的藥物,最常用的真核表達基因載體的標誌物有潮黴素(hygromycin)和新黴素(neomycin)在已有的技術狀態下,基因轉染效率很難達到100﹪。故必須首先將轉導細胞和未轉導的細胞加以區分。這樣的新技術發展很快,常用的轉導細胞篩選方法:
1.利用基因表達產物篩選法
(1)標記基因篩選法在載體上引入一個標記基因,或同時導入標記基因,在轉染後的適當時間選用合適劑量的選擇培養基,篩選標記基因表型,那些已導入外源基因的細胞將存活下來。
(2)基因缺陷型受體細胞的選擇性以基因缺陷型細胞作為靶細胞,將正常基因導入基因缺陷型靶細胞後,使用選擇性培養基進行篩選。
(3)基因共轉染技術將目的基因表達載體DNA和標記基因表達載體DNA混合後共同轉移到靶細胞中,分別使用標記基因和目的基因對應的選擇劑進行兩次篩選,最後得到複合轉導的轉化子。
2.分子生物學方法
外源基因是否真的轉入靶細胞必須用分子雜交方法進行證實。常用的方法有原位雜交、Southern雜交。其中主要問題是探針的選擇。
外源基因的表達和檢測
在篩選出轉化子後還需要鑑定轉導細胞中外源基因的表達狀況。其中包括對目的基因和標記基因的鑑定。常用方法有原位雜交、Northern雜交、免疫組織化學染色等,原位及Northern雜交是檢測外源基因轉錄出的mRNA,後者則是檢測外源基因翻譯出的蛋白質。
主要套用
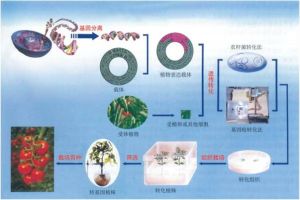 植物基因轉染套用過程
植物基因轉染套用過程1、用於建造疾病的動物模型和藥物篩選模型
2、用於基因治療
3、用於異種器官移植
4、用於改良動植物品種和生產性能
5、用於生產藥用蛋白和保健蛋白
6、用於生產人抗體