工具簡介
 血球計數板
血球計數板基本構造
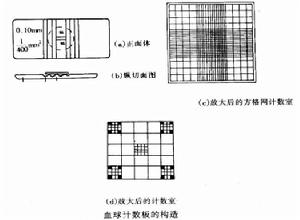
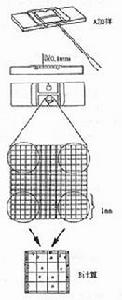
血球計數板是一塊特製的厚型載玻片,載玻片上有四個槽構成三個平台。中間的平台較寬,其中間又被一短橫槽分隔成兩半,每個半邊上面各刻有一小方格網,每個方格網共分九個大格,中央的一大格作為計數用,稱為計數區。計數區的刻度有兩種:一種是計數區分為16個大方格(大方格用三線隔開),而每個大方格又分成25個小方格;另一種是一個計數區分成25個大方格(大方格之間用雙線分開),而每個大方格又分成16個小方格。但是不管計數區是哪一種構造,它們都有一個共同特點,即計數區都由400個小方格組成。計數區邊長為1mm,則計數區的面積為lmm2,每個小方格的面積為1/400mm2。蓋上蓋玻片後,計數區的高度為0.1mm,所以每個計數區的體積為0.1mm3,每個小方格的體積為1/4000mm3。
使用血球計數板計數時,先要測定每個小方格中微生物的數量,再換算成每毫升菌液(或每克樣品)中微生物細胞的數量。
使用方法
 血球計數板
血球計數板2.取潔淨的血球計數板一塊,在計數區上蓋上一塊蓋玻片。
3.將菌懸液搖勻,用滴管吸取少許,從計數板中間平台兩側的溝槽內沿蓋玻片的下邊緣摘入一小滴(不宜過多),讓菌懸液利用液體的表面張力充滿計數區,勿使氣泡產生,並用吸水紙吸去溝槽中流出的多餘菌懸液。也可以將菌懸液直接滴加在計數區上(不要使計數區兩邊平台沾上菌懸液,以免加蓋蓋玻片後,造成計數區深度的升高),然後加蓋蓋玻片(勿使產生氣泡)。
4.靜置片刻,使細胞沉降到計數板上,不再隨液體漂移。將血球計數板放置於顯微鏡的載物台上夾穩,先在低倍鏡下找到計數區後,再轉換高倍鏡觀察並計數。由於生活細胞的折光率和水的折光率相近,觀察時應減弱光照的強度。
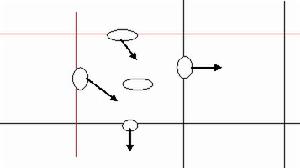
5.計數時若計數區是由16個大方格組成,按對角線方位,數左上、左下、右上、右下的4個大方格(即100小格)的菌數。如果是25個大方格組成的計數區,除數上述四個大方格外,還需數中央1個大方格的菌數(即80個小格)。為了保證計數的準確性,避免重複計數和漏記,在計數時,對沉降在格線上的細胞的統計應有統一的規定。如菌體位於大方格的雙線上,計數時則數上線不數下線,數左線不數右線,以減少誤差。即位於本格上線和左線上的細胞計入本格,本格的下線和右線上的細胞按規定計入相應的格中。見右圖:即本格中計數細胞為3個。
6.對於出芽的酵母菌,芽體達到母細胞大小一半時,即可作為兩個菌體計算。每個樣品重複計數2-3次(每次數值不應相差過大,否則應重新操作),按公式計算出每mL(g)菌懸液所含細胞數量。
7.測數完畢,取下蓋玻片,用水將血球計數板沖洗乾淨,切勿用硬物洗刷或抹擦,以免損壞格線刻度。洗淨後自行晾乾或用吹風機吹乾,放入盒內保存。
計數公式
1、16格×25格的血球計數板計算公式:
細胞數/ml=100小格內細胞個數/100×400×10000×稀釋倍數
1、25格×16格的血球計數板計算公式:
細胞數/ml=80小格內細胞個數/80×400×10000×稀釋倍數
不足之處
血球計數板在顯微鏡下直接進行測定。它觀察在一定的容積中的微生物的個體數目,然後推算出含菌數,簡便快捷。但是在計數時包括死活細胞均被計算在內,還有微小雜物也被計算在內。這樣得出結果往往偏高,因此適用於對形態個體較大的菌體或孢子進行計數。構造使用
血球計數板是由一塊比普通載玻片厚的特製玻片製成的。玻片中有四條下凹的槽,構成三個平台.中間的平台較寬,其中間又被一短橫槽隔為兩半,每半邊上面,刻有一個方格網。方格網上刻有9個大方格,其中只有中間的一個大方格為計數室,供微生物計數用。這一大方格的長和寬各為1mm,深度為0.1mm,其體積為0.1mm3。計數室通常有兩種規格。一種是大方格內分為16中格,每一中格又分為25小格;另一種是大方格內分為25中格,每一中格又分為16小格。但是不管計數室是哪一種構造;它們都有一個共同的特點,即每一大方格都是由16×25=25×16=400個小方格組成,見圖。
使用說明
 血球計數板
血球計數板(1)用血球計數板計數酵母菌懸液的酵母菌個數。
(2)樣品稀釋的目的是便於酵母菌懸液的計數,以每小方格內含有4-5個酵母細胞為宜,一般稀釋10倍即可。
(3)將血球計數板用擦鏡紙擦淨,在中央的計數室上加蓋專用的厚玻片。
(4)將稀釋後的酵母菌懸液,用吸管吸取一滴置於蓋玻片的邊緣,使菌液緩緩滲入,多餘的菌液用吸水紙吸取,捎待片刻,使酵母菌全部沉降到血球計數室內。
(5)計數時,如果使用16格×25格規格的計數室,要按對角線位,取左上,右上,左下,右下4箇中格(即100個小格)的酵母菌數.如果規格為25格×16格的計數板,除了取其4個對角方位外,還需再數中央的一個中格(即80個小方格)的酵母菌數。
(6)當遇到位於大格線上的酵母菌,一般只計數大方格的上方和右方線上的酵母細胞(或只計數下方和左方線上的酵母細胞)。
(7)對每個樣品計數三次,取其平均值,按下列公式計算每1ml菌液中所含的酵母菌個數。
3.計算公式
(1)16格×25格的血球計數板計算公式:
酵母細胞數/ml=100小格內酵母細胞個數/100×400×10四次方×稀釋倍數
(2)25格x16格的血球計數板計算公式:
酵母細胞數/ml=80小格內酵母細胞個數/80×400×10四次方×稀釋倍數
4.血球計數板的清潔
血球汁數板使用後,用自來水沖洗,切勿用硬物洗刷,洗後自行晾乾或用吹風機吹乾,或用95%的乙醇,無水乙醇,丙酮等有機溶劑脫水使其乾燥。通過鏡檢觀察每小格內是否殘留菌體或其他沉澱物。若不乾淨,則必須重複清洗直到乾淨為止。
誤差來源
 計算規則
計算規則1.避免技術誤差,糾正儀器誤差
(1)所用器材均應清潔乾燥,計數板、血蓋片、微量吸管及刻度吸管的規格應符合要求或經過校正。①計數板的鑑定:要求計數室的台面光滑、透明,劃線清晰,計數室劃線面積準確。必要時採用嚴格校正的目鏡測微計測量計數室的邊長與底面積,用微米千分尺測量計數室的深度。美國國家標準局(NBS)規定每個大方格邊長的誤差應小於1%,即1±0.01mm,深度誤差應小於2%,即0.1±0.002mm。若超過上述標準,應棄之不用。②血蓋片應具有一定的重量,平整、光滑、無裂痕,厚薄均勻一致,可使用卡尺多點測量(至少在9個點),不均勻度在0.002mm之內。必要時採用平面平行儀進行測量與評價,要求呈現密集平行的直線干涉條紋。最簡單的評價方法是將潔淨的蓋片緊貼於乾燥的平面玻璃上,若能吸附一定的時間不脫落,落下時呈弧線形鏇轉,表示蓋片平整、厚薄均勻。同時,合格的蓋片放置在計數室表面後,與支持柱緊密接觸的部位可見到彩虹。精選出的蓋片與其他蓋片緊密重合後,在掠射光線下觀察,如見到完整平行的彩虹條紋表示另一枚蓋片質量也符合要求。③目前臨床實驗室多採用一次性微量采血管採集毛細血管血,除注意定點購買使用信譽較好廠家的產品外,還應對每一批量的採血管進行抽樣檢查,可通過水銀稱重法或有色溶液比色法進行校正,誤差不應超過±1%。
(2)紅細胞稀釋液應等滲、新鮮、無雜質微粒。
(3)嚴格操作,從消毒、採血、稀釋、充池到計數都應規範,尤其應注意的是血樣稀釋及充池時既要作到充分混勻,又要防止劇烈震盪為破壞紅細胞。必須一次性充滿計數室,防止產生氣泡,充入細胞懸液的量以不超過計數室台面與血蓋片之間的矩形邊緣為宜。
(4)報告法定計量單位。
2.縮小計數域誤差或分布誤差由於血細胞在充入計數室後呈隨機分布或稱Poisson分布(),而我們所能計數的細胞分布範圍是有限的,由此造成的計數誤差稱為計數域誤差或分布誤差。縮小這種誤差的有效方法就是儘量擴大細胞計數範圍和計數數目,一般先進行誤差估計,然後決定所需計數的數目和計數範圍,只要能將誤差控制在允許範圍內即可。Berkson指出,當使用同一支吸管、同一面計數室,計數0.2mm2面積的細胞數,有望將CV控制在可接受的7%以內。對於紅細胞計數而言,由於紅細胞數量較多,在計數室中顯得比較“擁擠”,根據Poisson公式推斷。欲將誤差控制在變異百分數5%以內,至少需要在計數室中計數400個紅細胞,因此要求計數五個中方格的紅細胞。事實上Berkson還通過實驗證明,紅細胞的計數域誤差為s=0.92,較理論誤差(Poisson分布誤差)要小。
3.排除異常標本的干擾白細胞數量在正常範圍時,相對於紅細胞數量來講,其影響可忽略,但如白細胞過高(>100×109/L),則應對計數結果進行校正。方法是:①實際RBC=計得RBC-WBC。如當紅細胞換算後為3.5×1012/L、白細胞換算後為100×109/L時,病人實際紅細胞數應為3.4×1012/L。②在高倍鏡下計數時,避開有核細胞。有核細胞體積比正常紅細胞大,中央無凹陷,無草黃色折光,可隱約見到細胞核。此外,當病人急性嚴重貧血時網織紅細胞可提前大量釋放,也給紅細胞計數帶來一定的干擾,而且影響網織紅細胞絕對值計算結果。其校正方法有待探討。
微生物計數實驗
 血球計數板
血球計數板此法是利用血球計數板在顯微鏡下直接進行測定。它觀察在一定的容積中的微生物的個體數目,然後推算出含菌數,包括死活細胞均被計算在內,還有微小雜物也被計算在內。這樣得出結果往往偏高。這種方法常用於形態個體較大的菌體或孢子。
方法與步驟
1、取潔淨的血球計數板,在計數室上面蓋上蓋玻片。
2、取稀釋到一定程度(5~10個酵母/小格)酵母液,從蓋片邊緣滴一小滴,使菌液自行滲入,計數室內不能有氣泡。先在低倍鏡下找到小方格網後,再轉換高倍鏡觀察並計數。3、如用16X25計數板,只計四個角上中方格的菌數。若是25X16的計數板,除計數四個角上的中格菌數外,還要計算中央中格的菌數。每個樣品重複計數2~3次。計數時應不時調節焦距,才能觀察到不同深度的菌體。
4、位於格線上的酵母菌一般只計此格的上方線及左方線上的菌體。
5、計數方法:
樣品中菌數/ml=每小格平均菌數x4000,000x稀釋倍數,本實驗採用25x16規格,要求數這些方格中的全部小格即80個小格。
設:每箇中方格的菌數為A,則
每小格平均菌數=(A1+A2+A3+A4+A5)/80
樣品中的菌數/ml=(A1+A2+A3+A4+A5)/80X4000,000X稀釋倍數
測定注意事項:
1、測定時,酵母菌液要搖勻,防止酵母凝聚沉澱。
2、活酵母有芽殖現象,若芽體達到母細胞大小的一半時,即可作為兩個菌體計數,若芽體小於母細胞一半時為1個酵母細胞。
3、位於格線上的酵母菌一般只計此格的上方線及左方線上的菌體。