 游離碳
游離碳游離碳(F.C)是一種游離態的物質,一般用在工業碾磨和表面處理上的工業磨料。簡單的說游離碳和化合物相對,不易化合或很易從化合物中分離的碳,就是單質的碳,元素以單質形態存在叫游離,游離碳就是以單質存在的碳元素。日常生活中常見的有黑色鉛筆芯,石墨。
介紹
游離態在化學上,指一元素不與同種元素化合,而能單獨存在的狀態。元素以單質形態存在則為游離態。不同金屬的化學活動性不同,它們在自然界中存在形式也各不相同。少數化學性質不活潑的金屬,在自然界中能以游離態存在,如金、鉑、銀。化學成分對磨料性質影響較大,對碳化矽磨料而言,碳化矽含量越高,其硬度與磨削性能就越好,一級品碳化矽結晶塊通常含有98%左右SiC,雜質(主要有二氧化矽、矽、碳、鐵、鋁、鈣、鎂)約占2%。剛玉中化學成分同樣對磨料性質有較大影響,白剛玉由於比棕剛玉中Al2O3含量高,因而其硬度高於棕剛玉,性脆,具有良好切削性能;黑剛玉因Al2O3含量較低,故其硬度較低,而韌性較好,適用於製作塗附磨具。其它化學成分存在及含量多少,對剛玉性質也有較大影響,棕剛玉中TiO2含量增加,能使剛玉韌性增加;白剛玉中Na2O一種有害成分,由於它存在使得生成β——Al2O3結晶硬度降低,切削性能差,易破碎;如果在白剛玉冶煉過程中加入Cr2O3 ZrO2等化學成分,可以製造成鉻剛玉、鋯剛玉,使白剛玉性能得到改善,提高其韌性。
存在形式
 金剛石
金剛石1. 金剛石(diamond)
最為堅固的一種碳結構,其中的碳原子以晶體結構的形式排列,每一個碳原子與另外四個碳原子緊密鍵合,成空間網狀結構,最終形成了一種硬度大、活性差的固體。金剛石的熔點超過3500℃,相當於某些恆星表面溫度。主要作用:裝飾品、切割金屬材料等
2.石墨(graphite)
 石墨
石墨3.富勒烯(fullerene)
1985年由美國德克薩斯州羅斯大學的科學家發現。富勒烯中的碳原子是以球狀穹頂的結構鍵合在一起。
4.其他碳結構
無定形碳(Amorphous,不是真的異形體,內部結構是石墨)
碳納米管(Carbon nanotube)
六方金剛石(Lonsdaleite,與金剛石有相同的鍵型,但原子以六邊形排
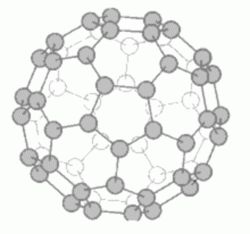 富勒烯
富勒烯趙石墨(Chaoite,石墨與隕石碰撞時產生,具有六邊形圖案的原子排列)
汞黝礦結構(Schwarzite,由於有七邊形的出現,六邊形層被扭曲到“負曲率”鞍形中的假想結構)
纖維碳(Filamentous carbon,小片堆成長鏈而形成的纖維)
碳氣凝膠(Carbon aerogels,密度極小的多孔結構,類似於熟知的矽氣凝膠)
碳納米泡沫(Carbon nanofoam,蛛網狀,有分形結構,密度是碳氣凝膠的百分之一,有鐵磁性)
