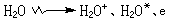水溶液輻射化學
正文
輻射化學的一個分支,研究電離輻射作用下水溶液的化學效應。很多化學、輻射化學和放射化學反應是在水溶液中或有水存在的情況下進行的,因此,研究水溶液輻射化學,不僅發展了輻射化學的理論和電離輻射對液相作用的原理,而且也充實了對基礎化學規律的研究,如水化電子存在的確證及其反應特性。它還對放射生物學和食品輻射化學的研究和核燃料後處理工藝、反應堆工藝的建立起著重要的和不可缺少的作用。研究概況 20世紀初,由於鐳的發現,開始了對水溶液輻射化學的研究。鐳鹽和氡的射線能使水溶液分解,放出H2、O2和H2O2等。隨著X射線用於醫療,對X射線引起的生物效應的研究促進了對水和水溶液輻射化學的研究,H.弗里克的工作起了重要的作用,他發現X射線照射Fe2+水溶液的過程中發生氧化還原反應,建立了利用亞鐵體系來測定X射線劑量的方法。40~60年代,原子能工業迅速發展,由於建造反應堆,需了解作為冷卻劑及慢化劑的水的輻射規律,核燃料後處理工藝也要求很好地研究無機物和有機物水溶液輻射化學問題,因此,水溶液輻射化學研究得到迅速的進展。測定了水輻解產生的·OH、H·等自由基產額及其系列反應的相對反應速率常數,並建立了自由基擴散理論。60年代中葉,用閃光光解、脈衝輻解技術證明了水化電子(見陷落電子)的存在,系統測定了水化電子的各種反應,充實了還原反應的理論。
目前,由於放射生物學的研究進入到分子生物水平以及食品輻照保藏技術的發展,要求更深入、系統地研究有機水溶液、生物物質水溶液和膠束水溶液的輻射化學。
反應機理 水溶液的輻射化學按溶質的濃度可分為稀水溶液(約為10-5~10-2摩/升)的輻射化學和濃水溶液(大於10-2摩/升)的輻射化學。濃水溶液和稀水溶液輻射化學的區別在於:①濃水溶液的離子強度、粘度和水的結構等與稀水溶液有顯著差別,因此其活性粒種(如eaq、H·、·OH、有機自由基R·等)的反應速率常數須作相應校正;②在濃溶液中,溶質的濃度會顯著影響水的分子產額和原初自由基產額,溶質可進入刺跡,甚至和未水化的電子反應;③當溶質濃度以重量計大於百分之幾時,就必須考慮輻射對溶質的直接作用。
電離輻射與溶劑水分子相互作用,其初級過程可用下式表示:
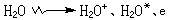
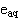 及分子產物H2、H2O2:
及分子產物H2、H2O2: H2O++H2O─→H3O++·OH
H2O*─→H·+·OH
H2O*─→H2+O

2H·─→H2
2·OH─→H2O2
在徑跡中的自由基濃度較高(約1摩/升),未反應的自由基隨徑跡的擴展而擴散,直至均勻分布於溶液。可用下列總反應式表示產生的自由基和分子產物: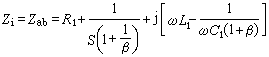
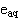 +H2O2─→·OH+OH-
+H2O2─→·OH+OH-
·OH+H2─→H2O+H·
H·+·OH─→H2O
當有溶質時,水輻射分解產生的自由基、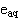 等可與溶質反應,其化學變化的主要過程可歸納為:①水化電子與溶質反應,它在鹼性水溶液中壽命較長(τ1/2=7.8×10-4 秒),在酸性水溶液中與H3O+作用生成氫原子。eaq是比氫原子更強的還原性粒子,可與溶質發生氧化還原反應,例如Cu2++eaq─→Cu++H2O;也可與大部分芳香族化合物、羧酸、醛、酮等起加成反應,如CH3COCH3+eaq─→
等可與溶質反應,其化學變化的主要過程可歸納為:①水化電子與溶質反應,它在鹼性水溶液中壽命較長(τ1/2=7.8×10-4 秒),在酸性水溶液中與H3O+作用生成氫原子。eaq是比氫原子更強的還原性粒子,可與溶質發生氧化還原反應,例如Cu2++eaq─→Cu++H2O;也可與大部分芳香族化合物、羧酸、醛、酮等起加成反應,如CH3COCH3+eaq─→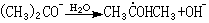 ;與脂肪族鹵化物發生定量脫鹵反應,如eaq+RX─→RX-─→R·+X-。②氫原子與溶質反應,它可與溶質起氧化還原反應,與含未成對電子的粒種、脂肪族不飽和化合物和芳香族化合物發生加成反應,如H+O2─→HO2;與脂肪族飽和化合物可發生抽氫反應,如CH3OH+H─→·CH2OH+H2。③·OH自由基與溶質反應,·OH是一種強氧化性自由基,因此可與變價的無機溶質反應,通過電子轉移而成為穩定的OH-離子,例如Fe2++·OH─→Fe3++OH-。·OH自由基可與芳香族有機化合物或脂肪族不飽和化合物起加成反應,與飽和化合物可發生抽氫反應,如·OH+CH3COCH3─→H2O+·CH2COCH3。④HO2·自由基與溶質反應, HO2·能起溫和的氧化劑或溫和還原劑的作用(放出 O2)。它可氧化還原性較強的溶質和將Fe2+氧化為Fe3+離子,又可還原氧化性強的溶質,如HO2·+Ce4+─→Ce3++O2+H+。⑤H2O2與溶質反應,H2O2也能起溫和的氧化劑或還原劑的作用,如H2O2+Ce4+─→Ce3++HO2·+H+,H2O2+Fe2+─→Fe3++·OH+OH-。
;與脂肪族鹵化物發生定量脫鹵反應,如eaq+RX─→RX-─→R·+X-。②氫原子與溶質反應,它可與溶質起氧化還原反應,與含未成對電子的粒種、脂肪族不飽和化合物和芳香族化合物發生加成反應,如H+O2─→HO2;與脂肪族飽和化合物可發生抽氫反應,如CH3OH+H─→·CH2OH+H2。③·OH自由基與溶質反應,·OH是一種強氧化性自由基,因此可與變價的無機溶質反應,通過電子轉移而成為穩定的OH-離子,例如Fe2++·OH─→Fe3++OH-。·OH自由基可與芳香族有機化合物或脂肪族不飽和化合物起加成反應,與飽和化合物可發生抽氫反應,如·OH+CH3COCH3─→H2O+·CH2COCH3。④HO2·自由基與溶質反應, HO2·能起溫和的氧化劑或溫和還原劑的作用(放出 O2)。它可氧化還原性較強的溶質和將Fe2+氧化為Fe3+離子,又可還原氧化性強的溶質,如HO2·+Ce4+─→Ce3++O2+H+。⑤H2O2與溶質反應,H2O2也能起溫和的氧化劑或還原劑的作用,如H2O2+Ce4+─→Ce3++HO2·+H+,H2O2+Fe2+─→Fe3++·OH+OH-。 參考書目
A.J.Swallow,Radiation Chemistry;An Introduction,Longman, London,1973.