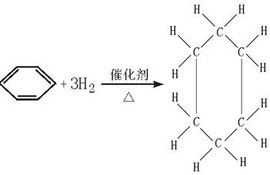
簡述
 加成反應
加成反應兩個或多個分子互相作用,生成一個加成產物的反應稱為加成反應(addition reaction)。加成反應可以是離子型的,自由基型的和協同的。離子型加成反應是化學鍵異裂引起的,分為親電加成(electrophilic addition)和親核加成(nucleophilic addition)。
加成反應進行後,重鍵打開,原來重鍵兩端的原子各連線上一個新的基團。加成反應一般是兩分子反應生成一分子,相當於無機化學的化合反應。根據機理,加成反應可分為親核加成反應,親電加成反應,自由基加成,和環加成。加成反應還可分為順式加成反式加成.加成反應進行後,重鍵打開,原來重鍵兩端的原子各連線上一個新的基團。加成反應一般是兩分
順式加成是指加成的兩部分從烯烴的同側加上去,
反式加成是指加成的兩部分從烯烴的異側加上去,
能發生加成反應的官能團:碳碳雙鍵、碳碳三鍵、碳氧雙鍵、碳氮三鍵、苯環。
親電反應
 加成反應
加成反應在烯烴的親電加成反應過程中,氫正離子首先進攻雙鍵(這一步是定速步驟),生成一個碳正離子,然後鹵素負離子再進攻碳負離子生成產物。立體化學研究發現,後續的鹵素負離子的進攻是從與氫離子相反的方向發生的,也就是反式加成。
烯烴親電加成反應 烯烴可以與多種親電試劑發生加成反應。例如烯徑與溴的加成,溴分子受到外界影響極化為一端帶微正電荷、另一端帶微負電荷的極性分子(見結構式a),其正端與烯烴雙鍵作用,最初形成π配位化合物(b),接著發生共價鍵異裂而得帶正電荷的σ配合物(c)和溴離子: 自由基加成
屬於自由基反應的範疇,比如博格曼芳香化成環反應。
烯烴與氯化氫或碘化氫在相同條件下不能進行自由基加成,這是因為由氯化氫產生氯原子的反應和碘原子加成到雙鍵上的反應都需要較高活化能,阻礙了鏈的轉移。 炔烴也能發生親電加成,但反應速率比相應烯烴慢。炔烴與溴化氫在過氧化物作用下也發生自由基加成,炔烴與硼烷的加成也與烯烴相似。但是,炔烴可以發生一些通常烯烴難以發生的親核加成反應。例如,乙炔在高溫高壓和鹼催化的條件下能分別與乙酸和乙醇發生反應,得到乙酸乙烯酯和乙烯基乙醚;乙炔與氫氰酸加成可得丙烯腈。這些都是工業生產中的重要反應。乙炔與水的加成一般在酸性汞鹽催化下進行,加成物乙烯醇不穩定,隨即異構化(見同分異構體)為乙醛,其反應機理尚不很清楚。c的正碳離子可能直接與溴離子結合(路線①),也可能先與其相鄰溴原子上未共電子對作用成為環狀正嗅離子(d),然後才與溴離子結合(路線②)。具體過程與烯烴結構和反應條件有關。烯烴不飽和碳原子上的給電子取代基使反應加速,吸電子取代基使反應減慢,這個事實可以證實上述反應機理。烯烴親電加成的立體化學與其結構和反應條件有關,一般以反式加成為主,即兩個原子或基團分別加在原雙鍵的兩面。 烯烴與無機酸和強有機酸都能發生親電加成,與弱有機酸的加成要在強酸催化下才能進行,加成產物為相應的酯,但烯烴與次鹵酸的加成產物卻是α-鹵代醇。烯烴與水在酸催化下發生加成反應生成醇,低級烯烴的這種反應是一些醇類的工業生產方法。當不對稱試劑與不對稱烯烴加成時一般都是符合馬爾科夫尼科夫規則,即試劑中的帶正電荷部分加在烯烴分子中含氫較多的不飽和碳原子上。 烯烴與硼烷的加成是合成中廣泛套用的反應。烯烴被有機過酸、臭氧和高錳酸鉀等試劑氧化,實質上也是這些氧化劑對於雙鍵的加成(見有機化學中的氧化還原反應)。烯烴與氫氣的加成要在催化劑作用下才能進行,常用催化劑有鎳、鉑、鈀、亞鉻酸銅及可溶於有機溶劑的氯化銠或氯化釕與三苯膦的配合物等(見催化氫化反應)。 烯烴與溴化氫在少量過氧化物作用下發生自由基加成,得到反馬氏加成物,這是一個鏈反應。例如在過氧化苯甲醯作用下丙烯與溴化氫的加成,鏈反應因溴原子的產生而引發,通過鏈的轉移而進行下去,自由基相互結合併消失而使鏈終止。鏈反應的三個過程簡單表示如下:烯烴與氯化氫或碘化氫在相同條件下不能進行自由基加成,這是因為由氯化氫產生氯原子的反應和碘原子加成到雙鍵上的反應都需要較高活化能,阻礙了鏈的轉移。炔烴也能發生親電加成,但反應速率比相應烯烴慢。炔烴與溴化氫在過氧化物作用下也發生自由基加成,炔烴與硼烷的加成也與烯烴相似。但是,炔烴可以發生一些通常烯烴難以發生的親核加成反應。例如,乙炔在高溫高壓和鹼催化的條件下能分別與乙酸和乙醇發生反應,得到乙酸乙烯酯和乙烯基乙醚;乙炔與氫氰酸加成可得丙烯腈。這些都是工業生產中的重要反應。乙炔與水的加成一般在酸性汞鹽催化下進行,加成物乙烯醇不穩定,隨即異構化(見同分異構體)為乙醛,其反應機理尚不很清楚。
環加成
屬於協同反應的範疇,常見的有狄爾斯-阿德爾反應。
加成聚合
經加成反應形成高聚物的過程稱為加成聚合反應,簡稱加聚反應。加聚反應的產物大多是聚烯類,常被用作包裝材料,如作為塑膠的聚乙烯、聚苯乙烯、聚氯乙烯等。
乙烯的加聚反應:實質是乙烯分子間的加成,即在適當的溫度、壓強和有催化劑的情況下,乙烯雙鍵里的一個鍵會斷裂,分子裡的碳原子能互相結合成為很長的鏈,生成聚乙烯。
相對比較
 乙醛的加成反應
乙醛的加成反應化學名詞
A-F
| ▪阿累尼烏斯方程 | ▪氨 | ▪螯合劑 | ▪螯合物 |
| ▪螯合物 | ▪半反應 | ▪半微量分析 | ▪苯 |
| ▪比色分析 | ▪變異係數 | ▪標定 | ▪標準電極電勢 |
| ▪標準曲線 | ▪標準溶液 | ▪標準自由能變 | ▪表征 |
| ▪查依采夫規則 | ▪產物 | ▪常規分析 | ▪常量分析 |
| ▪沉澱反應 | ▪陳化 | ▪臭氧 | ▪船型構象 |
| ▪醇 | ▪磁性 | ▪次序規則 | ▪催化 |
| ▪催化反應 | ▪催化劑 | ▪單分子親核取代反應 | ▪單分子消除反應 |
| ▪單色器 | ▪氮族元素 | ▪滴定 | ▪滴定度 |
| ▪滴定分析 | ▪滴定誤差 | ▪滴定終點 | ▪狄爾斯阿爾得反應 |
| ▪碘量法 | ▪電池電動勢 | ▪電負性 | ▪電荷數 |
| ▪電化學分析 | ▪電極電勢 | ▪電解 | ▪電解質 |
| ▪電離 | ▪電離能 | ▪電子 | ▪電子的波動性 |
| ▪電子構型 | ▪電子自鏇 | ▪定量分析 | ▪定性分析 |
| ▪對映體 | ▪多電子原子 | ▪多相離子平衡 | ▪多原子分子 |
| ▪二氧化碳 | ▪反應的活化能 | ▪反應方向 | ▪反應機理 |
| ▪反應級數 | ▪反應歷程 | ▪反應熱 | ▪反應速率 |
| ▪反應速率 | ▪范德華方程 | ▪芳香性 | ▪芳香族化合物 |
| ▪放射性 | ▪非金屬 | ▪非晶體 | ▪非均相催化劑 |
| ▪菲舍爾投影式 | ▪費林試劑 | ▪分光光度法 | ▪分析化學 |
| ▪分子軌道 | ▪分子軌道理論 | ▪分子間力 | ▪分子間作用力 |
| ▪分子空間構型 | ▪酚酞 | ▪伏特電池 | ▪副反應係數 |
| ▪傅列德爾克拉夫茨反應 |
G-L
| ▪蓋斯定律 | ▪高錳酸鉀 | ▪高錳酸鉀 | ▪格利雅試劑 |
| ▪汞 | ▪共沉澱 | ▪共軛二烯烴 | ▪共軛雙鍵 |
| ▪共軛酸鹼對 | ▪共軛酸鹼對 | ▪共軛體系 | ▪共軛效應 |
| ▪共價鍵 | ▪共價鍵 | ▪共性 | ▪構象異構體 |
| ▪構象 | ▪構型 | ▪孤對電子 | ▪官能團 |
| ▪光源 | ▪矽的存在和製備 | ▪矽酸 | ▪矽酸鹽 |
| ▪軌道 | ▪軌道能量 | ▪軌道重疊 | ▪過程 |
| ▪過渡金屬 | ▪過濾 | ▪過失誤差 | ▪過氧化氫 |
| ▪過氧化物和超氧化物 | ▪過氧化物效應 | ▪耗氧量 | ▪合金 |
| ▪核磁共振 | ▪核化學 | ▪核聚變 | ▪核裂變 |
| ▪紅外光譜 | ▪紅移 | ▪互變異構現象 | ▪化合物 |
| ▪化學反應 | ▪化學反應的通式 | ▪化學方程式配平 | ▪化學分析 |
| ▪化學計量點 | ▪化學位移 | ▪化學平衡 | ▪化學需氧量 |
| ▪化學因數 | ▪還原 | ▪緩衝容量 | ▪緩衝溶液 |
| ▪緩衝溶液 | ▪活化能 | ▪活性中間體 | ▪霍夫曼規則 |
| ▪基準物質 | ▪極性分子 | ▪繼沉澱 | ▪ 加成反應 |
| ▪甲基橙 | ▪價層電子對互斥理論 | ▪價鍵理論 | ▪價鍵理論 |
| ▪檢測系統 | ▪鹼金屬 | ▪鹼土金屬 | ▪鍵長 |
| ▪鍵級 | ▪鍵角 | ▪鍵矩 | ▪鍵能 |
| ▪結構異構 | ▪解蔽 | ▪解離常數 | ▪金屬 |
| ▪金屬鍵 | ▪金屬晶體 | ▪金屬離子的水解 | ▪金屬指示劑 |
| ▪晶體結構 | ▪精密度 | ▪聚合物 | ▪均相催化劑 |
| ▪開鏈族化合物 | ▪凱庫勒結構式 | ▪坎尼扎羅反應 | ▪克萊門森還原 |
| ▪克萊森酯縮合反應 | ▪克萊森重排 | ▪鑭系元素 | ▪累積穩定常數 |
| ▪離去基團 | ▪離子的沉澱與分離 | ▪離子的選擇沉澱 | ▪離子方程式配平 |
| ▪離子晶體 | ▪離子偶極力 | ▪理想氣體狀態方程分壓 | ▪立體化學 |
| ▪立體異構 | ▪立體異構體 | ▪量子數 | ▪列·沙特列原理 |
| ▪磷酸 | ▪磷酸鹽 | ▪零水準 | ▪硫化物 |
| ▪盧卡斯試劑 | ▪鹵代烴 | ▪鹵仿反應 | ▪鹵化磷 |
| ▪鹵化物 | ▪鹵素 | ▪路易斯酸鹼 | ▪氯化物 |
M-R
| ▪麥可反應 | ▪酶 | ▪醚 | ▪摩爾吸光係數 |
| ▪能斯特方程 | ▪紐曼投影式 | ▪濃度 | ▪偶極矩 |
| ▪偶然誤差 | ▪泡林不相容原理 | ▪配離子的形成 | ▪配位化合物 |
| ▪配位數 | ▪配位數 | ▪配位體 | ▪配位原子 |
| ▪硼氫化反應 | ▪硼烷 | ▪偏差 | ▪硼族元素 |
| ▪平衡常數 | ▪親電加成 | ▪親電試劑 | ▪親電性 |
| ▪親核加成 | ▪親核取代反應 | ▪親核試劑 | ▪氫化物 |
| ▪氫鍵 | ▪氫氧化物 | ▪氫原子的波爾模型 | ▪傾瀉法 |
| ▪球密堆積 | ▪區元素 | ▪醛 | ▪熱力學第二定律 |
| ▪熱力學第一定律 | ▪熱與功 | ▪溶度積常數 | ▪溶解度 |
| ▪溶解氧 |
S-Z
| ▪色譜分析 | ▪色散 | ▪熵 | ▪熵變 |
| ▪生成焓 | ▪石墨 | ▪試劑 | ▪鈰量法 |
| ▪手性分子 | ▪雙分子親核取代反應 | ▪雙分子消除反應 | ▪雙原子分子 |
| ▪水的離子積 | ▪水合氫離子 | ▪水合質子 | ▪水離解 |
| ▪順反異構 | ▪速率常數 | ▪酸和鹼 | ▪酸鹼 |
| ▪酸鹼的相對強度 | ▪酸鹼滴定法 | ▪酸鹼指示劑 | ▪酸鹼質子理論 |
| ▪酸效應係數 | ▪羧酸 | ▪羧酸衍生物 | ▪碳負離子 |
| ▪碳化物 | ▪碳水化合物 | ▪碳酸 | ▪碳酸鹽 |
| ▪碳正離子 | ▪碳族元素 | ▪鐵 | ▪同分異構體 |
| ▪同分異構現象 | ▪同離子效應 | ▪同位素 | ▪銅 |
| ▪酮 | ▪透光率 | ▪瓦爾登反轉 | ▪微量分析 |
| ▪位置異構體 | ▪物質的量 | ▪吸電子基 | ▪吸光率 |
| ▪吸熱與發熱過程 | ▪吸收池 | ▪烯丙基正離子 | ▪烯烴 |
| ▪稀有氣體 | ▪稀有氣體化合物 | ▪系統命名法 | ▪系統誤差 |
| ▪系統與環境 | ▪顯著性檢驗 | ▪線光譜 | ▪相 |
| ▪相對標準偏差 | ▪相轉移催化作用 | ▪消除反應 | ▪硝酸 |
| ▪校正曲線 | ▪鋅 | ▪興斯堡試驗 | ▪行 |
| ▪形態分析 | ▪休克爾規則 | ▪鏇光性 | ▪鹽 |
| ▪掩蔽 | ▪氧化 | ▪氧化還原電對 | ▪氧化還原反應 |
| ▪氧化還原指示 | ▪氧化劑和還原劑 | ▪氧化數 | ▪氧化物 |
| ▪氧族元素 | ▪一氧化碳 | ▪儀器分析 | ▪乙醇 |
| ▪乙二胺四乙酸 | ▪乙醚 | ▪乙醛 | ▪乙炔 |
| ▪乙酸 | ▪乙烯 | ▪乙醯化劑 | ▪異構現象 |
| ▪銀鏡反應 | ▪銀量法 | ▪有機化學 | ▪有效核電荷 |
| ▪有效數字 | ▪右鏇 | ▪誘導效應 | ▪元素的周期律 |
| ▪原電池 | ▪原子半徑 | ▪原子軌道 | ▪原子晶體 |
| ▪原子數 | ▪雜化 | ▪雜化軌道 | ▪雜化軌道 |
| ▪雜環化合物 | ▪線上分析 | ▪真實氣體 | ▪常態分配 |
| ▪脂肪族化合物 | ▪值 | ▪質量數 | ▪質子平衡 |
| ▪質子轉移反應 | ▪置信區間 | ▪置信水平 | ▪中心離子 |
| ▪仲裁分析 | ▪重鉻酸鉀 | ▪重鉻酸鉀 | ▪重鍵 |
| ▪重量分析法 | ▪周期表 | ▪狀態與狀態函式 | ▪準確度 |
| ▪灼燒 | ▪紫移 | ▪自發過程 | ▪總穩定常數 |
| ▪族 | ▪左鏇 |