物化性質
 氨基鈉
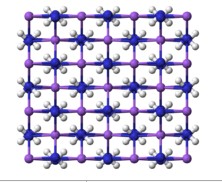
氨基鈉NaNH2為類鹽固體,晶格中鈉原子為四面體結構。溶於氨時,NaNH2溶液存在Na(NH3)6+ 和NH2- 離子,可導電。
氨基鈉是一種無機化合物,室溫下其試劑因其常含金屬鐵而呈灰色,有氨的氣味。氨基鈉與水強烈反應,露置空氣中易吸收水分和二氧化碳,是有機合成中常用的強鹼。400℃開始揮發,500~600℃分解成元素鈉、氮、氫。遇水反應劇烈,生成氫氧化鈉和氨,遇乙醇反應較慢。常保存在苯或甲苯中。
氨基鈉生成熱為-118.8KJ/moL,在空氣中易氧化,易燃。如色澤變黃,即變為疊氮化物因可能發生爆炸故不可再用,有腐蝕性和吸潮性。
製備方法
高溫法
由乾燥和脫氧過的氨通過250~360℃金屬鈉製得。2Na+2NH3→2NaNH2+H2低溫法
在硝酸鐵催化下鈉與液氨的反應來製備。在氨沸點(約-33°C)時反應最快,也更常用。用途
工業上,氨基鈉是製取靛青染料、肼和氰化鈉等工業品的原料。可用於乾燥液氨或氨氣,其液氨溶液也是有機化學中常用的強鹼。氨基鈉鹼性很強而且親核性很弱,但不易溶於大多數溶劑中,因而已被氫化鈉、雙(三甲矽基)氨基鈉(NaHMDS)以及二異丙基氨基鋰(LDA)等類似試劑所取代。製備炔烴
氨基鈉可使二溴代烷失去兩分子溴化氫,生成炔烴。如下圖製備苯乙炔的反應所示: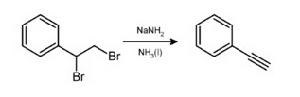 氨基鈉製備炔烴
氨基鈉製備炔烴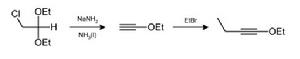 氨基鈉製備炔烴
氨基鈉製備炔烴成環反應
無β-氫可消除時,則可發生成環反應,見下面合成亞甲基環丙烷的反應: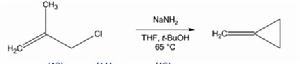 氨基鈉成環反應
氨基鈉成環反應去質子化
氫碳酸,包括末端炔烴、 甲基酮、環己酮、苯乙酸及衍生物和二苯甲烷等,都可被液氨中的氨基鈉脫去質子。用兩分子氨基鈉時,乙醯丙酮失去兩個質子生成雙負離子: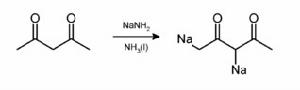 氨基鈉去質子化
氨基鈉去質子化合成吲哚
齊齊巴賓反應(Chichibabin反應),吡啶氨化合成2-氨基吡啶。其他反應
鄰位去質子化重排。達金反應(Darzen反應)合成氧雜環丙烷環系。安全
安全性概述
氨基鈉會與水猛烈反應生成氫氧化鈉和氨,且在空氣中可燃燒生成鈉氧化物及氮氣:NaNH2 + H2O → NH3 + NaOH2NaNH2 + 4O2 → Na2O2 + 2NO2 + 2H2O
氨基鈉應當儲存在密閉容器中,最好以氮氣保護。氨基鈉可能會對皮膚、眼部及黏膜有強腐蝕性,應當留心空氣中懸浮的氨基鈉粉末。
急救措施
處置逸出物料時須戴防毒面具與手套,用乾燥沙土混合併送至空曠地方,與大量水反應後放人廢水系統。對污染的地面也套用水沖洗;皮膚接觸,眼部受刺激,應立即用水沖洗;誤入口中,應立即漱口,飲水和醋或1%醋酸,然後送醫院救治。極少量殘渣可以小心地用大量清水沖洗。
較多量時可以放入甲苯溶液中,然後緩慢加入無水乙醇,待反應完全。大量時最好請相對專業的公司處理。
注意事項
1、當放置於密閉性不好的容器中時,氧氣和水不充足,有可能生成爆炸性的氧化產物從而使固體泛黃棕色,應經快銷毀,方法為向氨基鈉的烴類溶劑懸浮液中小心加入乙醇。2、打開蓋子時蓋口不要對著臉部。