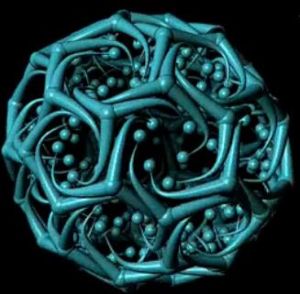
結構
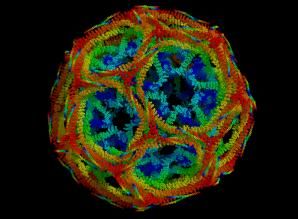 格線蛋白
格線蛋白格線蛋白(Clathrin)是一種進化上高度保守的蛋白質,由分子量為180kDa的重鏈和分子量為35~40kDa的輕鏈組成二聚體,三個二聚體形成包被的基本結構單位——三聯體骨架(triskelion),稱為三腿蛋白(three-leggedprotein)。有兩種類型的輕鏈:α鏈和β鏈,二者的胺基酸有60%是相同的,但還不知道它們在功能上有什麼差別。許多三腿複合物再組裝成六邊形或五邊形格線結構,即包被亞基,然後由這些格線蛋白亞基組裝成披格線蛋白小泡。
功能
運輸作用
格線蛋白在人體中起運輸的作用,生物分子激素、神經遞質、膜蛋白等物質都可通過格線蛋白進行運輸。
在內吞過程中,質膜上受體與配體特異結合部位的胞質面(將形成有被小泡的外衣)有一些蛋白附著:格線蛋白是其中最主要的一種蛋白。它是一種纖維蛋白,與另一種較小的多肽形成了有被小泡外衣的結構單位,即三腿蛋白複合物。三腿蛋白複合物包括三個格線蛋白和三個較小的多肽。由許多三腿蛋白複合物聚合構成五邊形或六邊形的格線樣結構,覆於有被小泡或有被小窩的胞質面。由格線蛋白裝配成的外衣提供了牽動質膜的機械力,導致有被小窩的下凹,也有助於捕獲膜上的特異受體及與之結合的被轉運分子;調節素是有被小泡中組成外衣的另一類重要的蛋白,它是多亞基的複合物,能識別特異的跨膜蛋白受體,並將其連線至三腿蛋白複合物上,起選擇性介導作用。跨膜受體蛋白胞質面肽鏈尾部,常在一個由四個胺基酸殘基構成的區域內高度轉折,形成一個內吞信號,由調節素識別它。所以調節素可介導不同類型受體,使細胞能捕獲不同類型的物質。
保證細胞正常分裂
2012年9月,美國加州大學舊金山分校生物工程與治療科學系教授弗朗西斯·布羅茨基和她的研究小組發現,如果沒有格線蛋白,細胞分裂會變得極不規律,而這正是癌症等人類疾病的一個特徵之一。
研究人員通過RNA干擾技術,向原有基因中注入一小段基因片段,以阻止格線蛋白的生成,刪除了細胞中的格線蛋白。結果發現,在沒有格線細胞的情況下,細胞分裂過程中中心體內的中心粒不是成對出現,而是毫無規律且越來越多。在經過進一步的篩選和識別後,布羅茨基的小組發現真正起作用的是一種名為CHC17的格線蛋白。如果刪除CHC17或用化學方法使其鈍化,就會導致細胞外觀異常。
通常當一個細胞分裂時,會產生結構蛋白形成紡錘體,並以此來分裂成兩個具有同樣DNA的新細胞。在刪除格線蛋白後,這一過程的對稱性和穩定性就遭到了破壞。這說明格線蛋白對細胞分裂至關重要。該發現找到了格線蛋白的一項“隱藏功能”,同時也為人們對癌症的認識和治療提供了一個新角度。