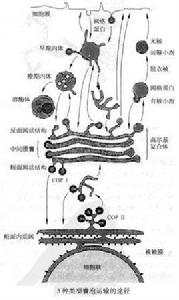
囊泡概念
囊泡是真核細胞中十分常見的膜泡結構。它不像內質網、高爾基複合體、溶酶體和過氧化物酶體那樣作為一種相對穩定的細胞內固有結構存在,但仍然是細胞內膜系統不可或缺的重要功能結構組分和細胞內物質定向運輸的載體功能和表現形式。承擔細胞內物質定向運輸的囊泡類型至少有10種以上。格線蛋白有被囊泡、COP I和COPⅡ有被囊泡是了解較多的三種囊泡類型。格線蛋白有被囊泡的形成需格線蛋白、銜接蛋白和動力蛋白的參與。
轉運過程
這種方式主要見於細胞器之間的蛋白質運輸,如蛋白質從內質網轉運到高爾基體以及從高爾基體轉運到溶酶體、分泌泡、細胞質膜、細胞外等,這種小泡稱為運輸小泡,轉運過程稱為囊泡運輸。運輸小泡直徑為50~100nm,通常從一個細胞器以芽生方式形成,小泡內包裹被運輸的蛋白質,當它到達靶細胞器時即與其融合,將蛋白質從一個細胞器運送到另一個細胞器。
蛋白質通過分泌途徑進行運輸至少可分為3個不同的階段,首先是蛋白質從內質網中輸出,然後呈遞到高爾基體;其次是高爾基體內的運輸;最後是高爾基體後的運輸,此步包括了從高爾基體的反面高爾基網路到內體和質膜的蛋白質運輸。蛋白質從內質網到高爾基體以及在高爾基體內的運輸要進行濃縮,通常稱之為分泌蛋白質的質量控制。
囊泡雖然可被視為是內膜系統重要的整體功能結構組分之一。但是與內質網、高爾基複合體、溶酶體以及過氧化物酶體等膜性細胞器不同,它們並非是一種相對穩定的細胞內固有結構,而只是細胞內物質定向運輸的載體和功能表現形式。
有被囊泡
據研究推測,承擔細胞內物質定向運輸的囊泡類型至少有10種以上。其中格線蛋白有被囊泡、COP I和COP II有被囊泡是了解較多的3種囊泡類型。
格線蛋白有被囊泡
格線蛋白有被囊泡可產生於高爾基複合體,也可由細胞膜受體介導的細胞內吞作用而形成。由高爾基複合體產生的格線蛋白小泡,主要介導從高爾基複合體向溶酶體、胞內體或質膜外的物質輸送轉運,而通過細胞內吞作用形成的格線蛋白小泡,即有被小泡(有被囊泡),則是將外來物質轉送到細胞質,或者從胞內體輸送到溶酶體。
1.格線蛋白
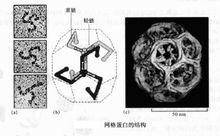 格線蛋白的結構
格線蛋白的結構格線蛋白有被小泡是研究最為透徹的一類囊泡,此類囊泡表面覆蓋一層纖維絲狀蛋白質,形同格線,故而得名。典型的格線蛋白有被囊泡直徑一般在50~100nm之間。由細胞質膜內凹或高爾基體反面膜囊外凸芽生而成。格線蛋門分子由3條重鏈和3條輕鏈組成,每一條重鏈與一條輕鏈組合在一起,形同一個外展的臂,3條臂組合在一起,形同格線蛋白的空間結構,因此格線蛋白也稱三條臂蛋白。格線蛋白重鏈的分子量為180KD,輕鏈為35~40KD。格線蛋白覆蓋於球形轉運囊泡表面,使後者張力大大提高。
該類囊泡的結構特點除以格線蛋白纖維構成的網路結構外,還有在格線蛋白結構外框與囊膜之間約20nm的間隙中填充許多銜接蛋白。
2.銜接蛋白
格線蛋白自身不能捕獲轉運分子,其囊泡捕獲特異性分子就是依靠銜接蛋白來實現的。銜接蛋白一方面形成相對於外側格線蛋白框架而言囊泡的內側結構,另一方面還介導格線蛋白與囊膜跨膜受體的連線,從而形成和維繫了格線蛋白一囊泡的一體化結構體系。已經發現的銜接蛋白有4種,它們選擇性地通過與不同受體一轉運分子複合體的結合,形成特定的轉運囊泡,進行不同的物質轉運。這種複雜的相互作用結果,還使得進入格線有被囊泡的被轉運物質受到了濃縮。其中3種銜接蛋白(AP1、AP2和AP3)性質已明。
3.動力蛋白
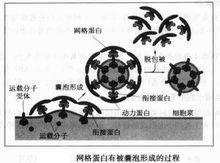 格線蛋白囊泡形成過程
格線蛋白囊泡形成過程格線蛋白有被囊泡的產生是一個非常複雜的過程,涉及到多種因素的參與和作用。在小泡的形成中,除格線蛋白與銜接蛋白之外,動力蛋白也稱縊斷蛋白——細胞質中一種可結合併水解GTP的特殊蛋白質,具有極其重要的作用。縊斷蛋白由900個胺基酸組成,在膜囊芽形成時,縊斷蛋白與GTP結合,並在外凸(或內凹)芽生膜囊的頸部聚合形成環狀,隨著它對GTP的水解進行,縊斷蛋白環向心縊縮,直至小泡斷離形成。而一旦小泡芽生形成,便會立即脫去格線蛋白外被,轉化為無被轉運囊泡,開始轉運運行。
COPⅡ有被囊泡
COPⅡ有被囊泡由粗面內質網所產生,屬於非格線蛋白有被囊泡類型,最早被發現於酵母細胞粗面內質網與胞漿及ATP的共育實驗。利用酵母細胞突變進行研究鑑定,發現COPⅡ外被蛋白由五種亞基組成。其中的Sar蛋白屬於一種小的GTP結合蛋白,它可通過與GTP或GDP的結合,來調節膜泡外被的裝配與去裝配。Sar蛋白亞基與GDP的結合,使之處於一種非活性狀態;當取而代之於GTP結合時,Sar蛋白就會被激活,並導致其結合與內質網膜,同時引發其他蛋白亞基組分在內質網膜上聚合、裝配、出芽,隨即斷離形成COPn有被囊泡。
COPⅡ囊泡主要負責介導從內質網到高爾基複合體的物質轉運。實驗證明,套用COPⅡ囊泡外被蛋白的抗體,能夠有效阻止內質網膜小泡的出芽。有人用綠色螢光蛋白(GFP)標記示蹤技術觀察COPⅡ有被囊泡的轉運途徑發現:當COPⅡ囊泡在內質網生成之後,在向高爾基複合體的轉移途中,常常數個彼此先行融合,形成所謂的”內質網一高爾基體中間體”,然後再沿微管系統繼續進行,最終到達高爾基複合體之順面(形成面)。COPⅡ囊泡在抵達其靶標之後,與靶膜融合之前,即由結合的GTP水解,產生Sar-GDP複合物,促使囊泡包被蛋白發生去裝配,導致囊泡脫去衣被稱為無被轉運囊泡。
COPⅠ有被囊泡
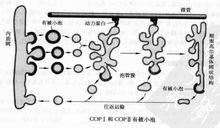 COP I和COP II有被小泡
COP I和COP II有被小泡COPⅠ囊泡首先發現於高爾基複合體,亦屬於非格線蛋白有被囊泡類型。主要介導蛋白質從高爾基體運回內質網,包括從外側高爾基體運向內側高爾基體以及將蛋白質從內側高爾基體運回內質網。
COPⅠ外被蛋白覆蓋於囊泡表面,也是一種由多個亞基組成的多聚體。發現COPⅠ有被囊泡外被蛋白的α、β、γ、ε、ζ等幾種蛋白亞基成分,其中a蛋白(也稱ARF蛋白)類似於COP II中Sar蛋白亞基,即作為一種GTP結合蛋白,可調節控制外被蛋白複合物的聚合、裝配及膜泡的轉運。
形成和定向運輸
3種不同運輸小泡的形成和定向運輸都是由信號指導的。如KDEL信號是內質網蛋白的滯留信號,因此KDEL是COPⅠ被膜小泡形成的信號。小泡的形成不僅需要信號,同時也需要銜接蛋白和信號受體。
方式途徑
囊泡的形成
在真核細胞中,蛋白質分子沿著胞吞和分泌的途徑進行運輸,分子運輸到正確的目的地並不影響細胞及細胞器結構的完整。囊泡從細胞質膜或細胞內膜系統芽生後,需經規定的途徑才能到達靶細胞器,並卸載所轉運的物質。從內質網到高爾基體之間的轉運可通過簡單彌散來完成。但從高爾基體到細胞質膜的路程長,需要藉助某種蛋白質才能完成轉運。囊泡運輸從一個細胞器芽生到抵達另一靶細胞器並卸載所轉運的物質,經過識別、停靠與融合等過程。
膜泡介導的蛋白質運輸,無論是正向還是反向,都經歷了3個主要步驟。首先是被蛋白以膜泡形式出芽和膜泡中貨物的選擇(COPⅡ被蛋白質介導運輸的蛋白質從ER中輸出,COP I被蛋白質介導高爾基器和ER之間以及不同的高爾基瀦泡之間的反向運輸。此外,COPⅠ被也參與穿過高爾基器的前向運輸以及內吞膜泡的運輸);第二步是膜泡運輸到相關的受體腔膜上並被束縛,Rab GTP酶家族的成員、相關的效應蛋白質和細胞骨架蛋白質在此步中起重要的作用;最後,膜泡錨定到受體腔膜上並與之融合,這一步至少部分的是通過SNARE蛋白質介導的。
囊泡在靶細胞器的停靠
膜泡產生出來之後,必須經過合適的定向以與靶膜(如順面高爾基器膜)或其他膜融合。就如從ER中形成膜泡需要一些特異的蛋白質一樣,膜泡的定向和與靶膜的融合也需要一些特異的組分參與,這些組分包括Rab GTP酶、束縛因子和SNARE複合物。
運輸的膜泡在運輸過程中必須與靶膜融合以達到運輸的目的。從分子水乎上來解釋這種融合機制的模型稱為SNARE假說。該假說認為每種類型的運輸膜泡都有不同的V - SNARE(神經元細胞中為VAMP-2),可與相應靶膜上的特異的t - SNARE(神經元細胞中為SNAP - 25)識別配對,通過這種特異的相互作用將膜泡錨定到靶膜上,然後在α-NAP輔助下,通過NSF的ATP酶活性可逆地解離SNARE複合物,驅動膜融合。該假說認為膜泡的運輸是特異的,因為介導膜泡融合的SNARE蛋白之間的結合是特異的。事實上許多不同的SNARE蛋白定位於不同的胞內腔室。
一旦轉運囊泡識別靶細胞質膜,便在此停靠,接著囊泡與質膜融合併釋放出轉運分子。囊泡與靶細胞器質膜錨定後,不僅將所轉運分子釋放至細胞器腔內,而且還把囊泡膜融合到細胞器的膜上。囊泡錨定不僅需要一套特定信號分子,同時,也需要囊泡與質膜緊密相接,才能使得質膜上彼此突出的蛋白質相互作用,啟動融合過程。囊泡融合要求囊泡與靶細胞質膜的接觸要更加緊密(雙方距離在1.5nm之內)。為使它們緊密接觸,必須去除膜親水面的水分子,這一過程消耗大量能量,那么這些能量來自何方?研究發現,細胞內所有的膜融合很可能是由一種特異蛋白催化完成的,該蛋白質在質膜的融合部位合成,謂之融合蛋白,與SNAREs組裝成融合複合物,為這一過程節約能量。同SNAREs一樣,已經分離出許多催化囊泡融合的胞漿蛋白,但它們如何發揮作用還不知道。
囊泡與靶細胞器的融合
雖然囊泡轉運的目的看似簡單,即將囊泡中轉運的蛋白質交給靶細胞器便大功告成,但轉運囊泡的融合卻相當複雜,而且每一種囊泡的融合各具特點。上面提到3種囊泡融合的共同點是:
①包被蛋白在囊泡發生融合前必須脫去,也稱解聚;
②轉運囊泡的囊膜上存在著決定轉運方向的信號蛋白v-SNAREs,它與靶細胞器上的t-SNAREs互補,確保轉運囊泡準確到達於此並與之融合。
1.SNARE假說
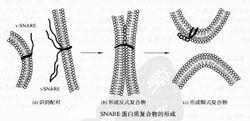 SNARE蛋白質複合物的形成
SNARE蛋白質複合物的形成從分子水平上來解釋膜泡運輸過程中融合機制的主要模型為SNARE假說。該假說認為每種類型的運輸膜泡都有不同的v-SNARE蛋白質,可與相應靶膜上的特異的t-SNARE識別配對,通過這種特異的相互作用將膜泡錨定到靶膜上,形成反式SNARE複合物,然後在α-SNAP蛋白質的輔助下,通過NSF蛋白質的ATP酶活性可逆地解離SNARE蛋白質複合物,驅動膜融合,形成順式SNARE複合物。該假說認為膜泡的運輸是特異的,因為介導膜泡融合的SNARE蛋白質之間的相互作用是特異的。儘管SNARE蛋白質最先是在神經元突觸膜泡和質膜上發現的,但其同源物也存在於細胞間的其他運輸過程中。幾乎膜運輸的每一步都是由一對不同的SNARE蛋白質(v-SNARE和t- SNARE)來進行的。SNARE蛋白質介導胞內不同的膜泡運輸,如ER到高爾基體和高爾基體到質膜等的運輸;且SNARE蛋白質從酵母到人類都是保守的。
2.SNARE蛋白質的種類
SNARE蛋白質在所有迄今研究過的胞內運輸途徑巾仍然占據著中心位置。Syntaxin、SNAP25和VAMP/synaptobrevin是最先發現的SNARE蛋白質,也是研究最為詳細的SNARE蛋白質。囊泡融合至少涉及3種蛋白質參與,v- SNARE、t- SNARE和SNAP25,也稱為融合錨定蛋白。SNAP25由兩條a-螺鏇肽鏈組成,常與t- SNAREs相伴,為v-SNAREs的受體。體外研究表明,當含v - SNAREs脂質體與含t-SNAREs/SNAP25脂質體相接觸時,先有錨定蛋白的結合,即兩條α鏈的SNAP25與另各由一條a鏈的v-SNAREs和t-SNAREs相互織纏,將雙方牢牢系住。這一過程在數秒鐘即可完成。真核細胞中,除了上述3種蛋白,還有N-乙基馬來醯亞胺敏感因子(NSF)參與囊泡融合。AFS為等大四聚體蛋白,可催化ATP水解。此外α-、β-、γ-SNAPs也參加囊泡融合過程。
SNARE是一些小的蛋白質,分子量為18~42KD。所有SNARE蛋白的標誌是它們在近膜端區都含約60個保守的胺基酸殘基組成的七段重複序列(稱為SNARE基序)。可以形成coiled - coil結構,此螺鏇束可連線兩個相對的膜進行膜融合。例外是SNAP25蛋白質,這個蛋白質有兩個SNARE基序,通過該蛋白質中央部分共價連線的棕櫚醯基團而結合到膜上。大多數SNARE蛋白質是羧端錨定的跨膜蛋白(Ⅱ型整合膜蛋白質),帶一很短的胞質外結構域或不帶,具功能的氨基端朝向胞液。但也有許多SNARE蛋白質是通過棕櫚醯化或異戊二烯化錨定在膜上,而沒有跨膜結構域。
3.Rab蛋白在囊泡轉運與融合中的調節作用
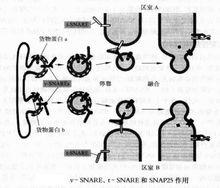 融合錨定蛋白的作用
融合錨定蛋白的作用除了錨定蛋白外,還有其他一些蛋白參與調節囊泡轉運。這其中Rab尤為重要。Rab屬GTP結合家族,含有200個胺基酸,蛋白結構與Ras極為相似,通過不斷結合與水解ATP的循環過程,調節囊泡的融合速度。胞漿中存在著異種蛋白,稱為GDI,可特異性催化Rab與GDP解離,並與GTP結合,使Rab分子構象發生改變,從而同轉運囊泡表面蛋白迅速結合。當囊泡融合時,GTP水解成GDP,與Rab分離。可以看出,Rab與GDP結合,再置換GTP,最後水解GTP構成調節囊泡融合的整個過程。這一循環過程受到Rab/GTP絕對結合率的嚴格調節。至於何種蛋白參與其調節,尚不得知。
有實驗結果顯示,Rab為囊泡融合的“定時器”。在早期內體發現有Rab5存在。所謂早期內體實際上是格線蛋白囊泡內吞時在細胞膜內側迅速形成的融合體。沒有Rab5參與,內體就不能形成。換言之,囊泡不能融合。在無細胞提取液中加入Rab5,囊泡融合加速。同理,Rabl調節著內質網到高爾基體轉運囊泡的融合過程。如果將Rabl換成Rab5和Rab7,則對這一過程無效。酵母Sec4基因編碼的蛋白與細胞Rab同源。如果將Sec4突變,則分泌囊泡不能與細胞融合。然而有關Rab與V-SNARE是否相互作用決定囊泡的去向,還有待闡明。
研究突破
 2013年諾貝爾生理學獎得主
2013年諾貝爾生理學獎得主2013年當地時間10月7日,瑞典斯德哥爾摩,2013年諾貝爾生理學或醫學獎揭曉,耶魯大學教授詹姆斯-E.羅斯曼、加州大學伯克利分校教授蘭迪-W.謝克曼及德國生物化學家托馬斯-C.蘇德霍夫因在細胞內主要運輸系統的新發現獲獎。諾獎委員會說,三人發現了細胞囊泡交通的運行與調節機制。
獲獎理由:發現了細胞囊泡運輸系統的運行與調節機制。根據三名科學家的發現,每個細胞都是一個生產和傳送分子的工廠。分子通過細胞周圍的囊泡在正確的時間傳送到身體所需部位。他們的基礎發現有助於治療因為細胞運輸混亂而造成的疾病,如神經性疾病、糖尿病以及免疫組織紊亂等。