定律定義
焓具有能量的量綱,一定質量的物質按定壓可逆過程由一種狀態變為另一種狀態,焓的增量便等於在此過程中吸入的熱量。
焓定義為H=U+pV,式中U為物質的內能,p為壓力,V為體積。
理論詮釋
 焓
焓H=U+pV(1)
式中U、p和V分別為該體系的內能、壓強和體積。H即焓,也是狀態函式,而且是一個廣延量。當系統進行某一過程時,焓的變數ΔH只與始態、終態有關,而與中間過程無關。焓具有能量的量綱。焓的單位為焦耳(J)。“焓”是荷蘭物理學家H.昂內斯提出的,來自希臘文,含義是“加熱”,因為特定的過程中,焓的變數ΔH與熱量有關。焓曾有許多別的名稱,如熱焓、熱容量、熱函式和吉布斯熱函式等。
由熱力學第一定律可以導出,若一個封閉的熱力學體系經歷一個等壓過程,而且在此過程中體系只有因體積變化而由壓力作的功(即體積功),則該過程體系吸收或放出的熱就等於在此過程中體系的焓變,即:
ΔH=Qp(2)
上式被廣泛套用於計算熱工及化工過程的熱效應。
對於理想氣體,焓僅是溫度的函式。對於可逆定壓過程,加給單位物質的熱量在數值上等於該物質比焓的增加。根據焓的定義,在流動過程中焓代表物質向前方傳遞的內能和流動功之和。因此在分析開口系統(見熱力系統)的能量交換時,焓是常用的參數。
相對焓值
在熱力學中,焓的絕對值是無法得到的,因此通常採用選取某些物質作為基準,通過測定或計算與基準物質間的焓的差值,得到其他物質的相對焓值的方法。例如,在計算化學反應的焓變時,規定在反應溫度和標準壓力下,所有穩定單質的焓值為零,而由穩定單質生成1摩爾某化合物的反應的焓變稱為此化合物在該溫度下的摩爾生成焓,記為ΔfHm。這樣,一個在某溫度下進行的任意的化學反應的焓變就等於該溫度下產物的總生成焓減去反應物的總生成焓。例如,對反應2SO2(氣)+O2(氣)→2SO3(氣)(3)
ΔH=2ΔfHm(SO3,氣)-2ΔfHm(SO2,氣)
一些常見物質在298.15K的標準摩爾生成焓可從各種化學化工手冊上查到。根據類似的原理,化學反應的焓變還可通過物質的標準摩爾燃燒焓、鍵焓等計算。
當體系經歷一個沒有相變和化學反應的等壓變溫過程時,體系的焓變可由下式計算:
ΔH=Cp(T2-T1)(4)
式中Cp是體系的定壓熱容,即體系在等壓且只作體積功的條件下溫度升高1K所吸收的熱量,T1、T2分別為體系初態和末態的溫度。
如果已經知道某一相變過程或化學反應在某一溫度T1下的焓變ΔH1,要求另一溫度T2下的焓變ΔH2,則可通過下式計算:
ΔH2=ΔH1+ΔCp(T2-T1)(5)
式中ΔCp是產物的總的定壓熱容和反應物的總的定壓熱容的差值。例如,對反應(3):
ΔCp=2Cp(SO3)-2Cp(SO2)-Cp(O2)
在式(4)和(5)的計算中,若T1、T2相差較大,則Cp套用該物質在此溫度區間的平均熱容。
焓變與熱效應
在特定過程中,焓變與熱效應有關。如果在恆壓和只做體積功的條件下進行某一過程,系統的焓變ΔH才等於恆壓過程熱效應。化學上很多過程符合上面兩個條件,如恆壓相轉變(熔融、升華、沸騰)和恆壓的化學變化等。因此,可通過焓變ΔH研究恆壓過程熱效應。焓變的套用
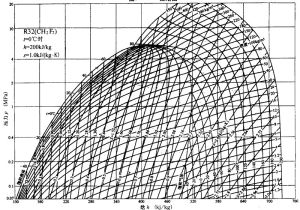
在化學反應中,焓的增量ΔH等於反應熱;在相變過程中,ΔH等於相變潛熱(見潛熱);對於僅有溫度變化而無相變和化學反應的系統,其焓的增量與溫度改變數之比就等於該系統的定壓熱容Cp。焓在熱工和化工上套用很普遍,因許多熱學過程和化學反應都是在等壓條件下進行的。這時可以由焓差來計算系統所吸收的熱量。又由於焓是態函式,焓差只決定於系統的初、終態而與具體過程無關,故在熱工和化工計算中,從特製的圖表查出物質在初、終態的焓值,即可知相應過程所吸收的熱量。
氣體焓
熱力學中表征物質系統能量的一個重要狀態參量,單位質量物質的焓稱為比焓,表示為h=u+p/ρ,u為單位質量物質的內能(稱為比內能),ρ為密度,1/ρ為單位質量物質的體積。一定質量的物質按定壓可逆過程由一種狀態變為另一種狀態,焓的增量便等於在此過程中吸入的熱量。氣體的內能是氣體分子微觀運動的動能,其中包括分子的平移動能、分子轉動動能和分子內部的振動以及離解能量等。單原子氣體分子只有平移動能,多原子氣體分子除具有平移動能外,還有轉動和振動能。在熱力學溫度1500K以下,振動和離解能可忽略不計,氣體內能只包括平移動能和轉動能。這兩部分能量在理論上都正比於熱力學溫度T。對於完全氣體(在常溫常壓下,空氣與完全氣體很相近),定壓比熱cp可視為常數,單位質量氣體的焓等於cp和氣體熱力學溫度T的乘積,即h=cpT。實驗測定實際氣體的cp同T和p都有關係,溫度的影響比壓強要大一些,但影響都不很大。在理論和工程計算中,cp常被看成常數。在氣流問題中,氣體的比焓等於氣體內能和流動功之和,因為p/ρ等於單位質量流體流進某流管截面時反抗壓力所作的功(即流動功)。單位質量氣體的總能量等於比焓與巨觀流動動能之和,稱為總比焓,通常以h0表示。在與外界沒有能量交換的氣流中,沿流管氣體的總比焓不變,即h0為常值。