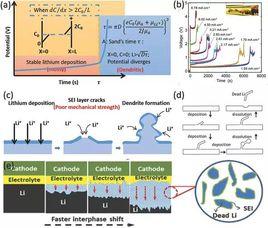
例子
鐵器在潮濕空氣中生鏽;鐵從硫酸銅溶液中置換出銅;鋅從稀硫酸中置換出氫氣等。
注意
化學熱力學指出,熵增加,焓減小的反應必定是自發反應。自發反應不一定是快速反應。
如無鈀作催化劑常溫常壓下氫氧混合氣可長期保持無明顯反應。在同等條件下,自發反應的逆反應都是非自發的,須給予外力對之作功才能進行。
判斷
△G=△H-T△S
△G——吉布斯自由能變
△H——焓變(△H<0為放熱反應,△H>0為吸熱反應)
△S——熵變(物質混亂度的量度,如固體變成氣體或氣體體積增大,則混亂度增加,△S>0)
T——開氏溫度(永遠不可能為負值) 判斷反應能否自發進行用吉布斯自由能判據。
如果△G<0 反應可以自發進行;反之則不可以自發進行。
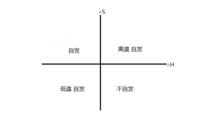 自發反應
自發反應恆溫恆壓下:
當△H<0,△S>0時,反應自發進行;
當△H>0,△S<0時,反應不自發進行;
當△H>0,△S>0時,需要在較高溫度的條件下,才能自發進行。
當△H<0,△S<0時,需要在較低溫度的條件下,才能自發進行。
一般低溫時焓變影響為主;高溫時,熵變影響為主,而溫度影響的大小要看△H和△S的具體數值而定。
註解
反應總是在一定條件下進行的。要討論反應的自發性,也要指明反應條件。如果沒有交代反應條件,只講“某某反應不自發”“某某反應自發”,實際上是指在常溫常壓下進行的反應。“一定條件”指“一定的溫度一定壓強”。例如,反應 CaCO3== CaO + CO2↑ 在常溫常壓是非自發的,而在高溫下則是自發發生的。 用吉布地自由能計算公式(△G=△H-T△S)來判斷反應能否自發進行時,可以看到T對△G的值有影響,在某些情況下,可能決定△G是大於0還是小於0;式中△H 是一個與溫度、壓強有關的物理量。因此,討論△G是大於0還是小於0,實際上也是在一定溫度與壓強下進行的。
“外界幫助”這句話中,指的是為反應體系提供能量。“幫助”並不是指提供反應發生的溫度和壓強等反應條件,也不是點燃、使用催化劑等等。一定的溫度、一定的壓強是反應所需要的條件。很多場合下,提高溫度,往往是為了加速反應。合成氨反應在常溫常壓下,△G<0,是放熱的自發反應。但是,常溫常壓下實際上無法覺察到反應的發生,只有在高溫、高壓、催化劑存在下,才有實際的套用價值。又如,硝酸銨NH4NO3的分解反應, △H<0 △S>0,在任何溫度下都能自發進行。在常溫常壓下,反應速率慢,難以觀察到反應的發生。但加熱到高溫,或受猛烈撞擊,發生爆炸性分解:2NH4NO3=N2↑+O2↑+4H2O。撞擊或加熱大大提高反應速率,發生劇烈分解。氫氣氧氣化合成水的反應在常溫下也是自發的。常溫下將H2與O2混合,不能觀察到有明顯現象,在氫氧燃料電池中,反應在常溫下就能進行。在鈀粉催化下H2與O2的混合氣體也能快速生成水。點燃氫氣氧氣,能迅速化合成水,也只是加速了反應速率。
從熱力學分析,“外界幫助”指的是對體系做“有用功”。例如,水的分解在常溫常壓下是不自發的,但通電,為體系提供電能,可以使水分解成H2和O2 。電解反應都是非自發反應,“通電”對體系做有用功,使反應在常溫常壓下得以進行。而原電池反應是自發反應,它能對外作電功。自發反應和其他自發過程一樣,具有對外作功的能力。因此,自發反應和非自發反應的區別在於在一定條件下,反應的發生是需要外界對體系作功,還是反應體系具有能對外界作功的能力。