簡介
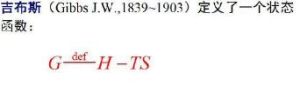 公式
公式它的定義為:G = U − TS + pV = H − TS
其中U是系統的內能,T是溫度,S是熵,p是壓強,V是體積,H是焓。
定義
ΔG=ΔH-ΔST
G叫做 吉布斯自由能。因為H、T、S均為狀態函式,所以G為狀態函式。
其單位為KJ/mol
判據
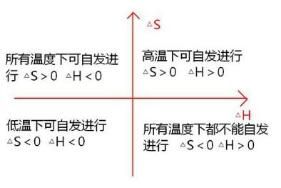
吉布斯自由能的變化可作為恆溫、恆壓過程自發與平衡的判據;ΔG叫做吉布斯自由能變
ΔG<0 反應自發進行
ΔG=0 反應平衡
ΔG>0逆方向自發進行
等溫等壓下體系的吉布斯自由能減小的方向是不做非 體積功的化學反應進行的方向。任何等溫等壓下不做非體積功的 自發過程的吉布斯自由能都將減少。