提出
1864年,古德伯格(G.M.Guldberg)提出化學平衡常數,成為化學平衡的動力學真實圖像。
表達式
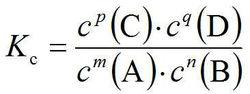 化學平衡常數表達式
化學平衡常數表達式對於可逆化學反應 mA+ nB⇋ pC+qD在一定溫度下達到化學平衡時,其平衡常數表達式為:
 化學平衡常數
化學平衡常數在高中階段,我們將平衡常數表達式書寫成如右圖所示的形式。
注意問題
在書寫平衡常數表達式時,要注意以下問題:
① 在套用平衡常數表達式時,稀溶液中的水分子濃度可不寫。因為稀溶液的密度接近於1 g/mL。水的物質的量濃度為55.6 mol/L。在化學變化過程中,水量的改變對水的濃度變化影響極小,所以水的濃度是一個常數,此常數可歸併到平衡常數中去。
對於不以水為溶劑的溶液中的反應,溶劑的濃度同樣是常數。
② 當反應中有固體物質參加時,分子間的碰撞只能在固體表面進行,固體的物質的量濃度對反應速率和平衡沒有影響,因此,固體的“濃度”作為常數,在平衡常數表達式中,就不寫固體的濃度。
③ 化學平衡常數表達式與化學方程式的書寫方式有關。同一個化學反應,由於書寫的方式不同,各反應物、生成物的化學計量數不同,平衡常數就不同。但是這些平衡常數可以相互換算。
④ 不同的化學平衡體系,其平衡常數不一樣。平衡常數大,說明生成物的平衡濃度較大,反應物的平衡濃度相對較小,即表明反應進行得較完全。因此,平衡常數的大小可以表示反應進行的程度。
⑤一般認為 K>10^5反應較完全(即不可逆反應), K<10^(-5)反應很難進行(即不反應)。
平衡常數的數值大小可以判斷反應進行的程度
測定方法
平衡常數可以用實驗方法測定,也可以利用熱力學數據計算而得。
實驗方法通常有化學方法和物理方法。
化學方法
 化學平衡常數
化學平衡常數化學方法是通過化學分析法測定反應達到平衡時各物質的濃度。但必須防止因測定過程中加入化學試劑而干擾了化學平衡。因此,在進行化學分析之前必須使化學平衡“凍結”在原來平衡的狀態。通常採用的方法是採取驟冷、稀釋或加入阻化劑使反應停止,然後進行分析。例如,要測定反應2H+O2HO在2 000 ℃達到平衡時的平衡常數,可以將一定量的水置於耐高溫的合金管中加熱,在2 000 ℃時保持一段時間,使之達到化學平衡。然後,將管子驟然冷卻,再分析其中HO、H、O的含量,便可計算出在2 000 ℃時這個反應的平衡常數。
物理方法
物理方法就是利用物質的物理性質的變化測定達到平衡時各物質濃度的變化,如通過測定體系的折光率、電導、顏色、壓強或容積的改變來測定物質的濃度。物理方法的優點是在測定時不會干擾或破壞體系的平衡狀態。
單位
平衡常數的單位比較複雜,有標準平衡常數和非標準平衡常數之分,前者的量綱為一,後者的量綱取決於平衡常數的表達式。
根據標準熱力學函式算得的平衡常數是標準平衡常數,記作K,又稱之為熱力學平衡常數;用平衡時生成物對反應物的壓力商或濃度商表示的平衡常數是經驗平衡常數(Kp或Kc),或稱作非標準平衡常數。中學教材中涉及的平衡常數是經驗平衡常數。
大家知道,一些重要的熱力學函式,如U、H、F、G等的絕對值是無法確定的。為了計算它們的相對大小,需要統一規定一個狀態作為比較的標準,這樣才不致引起混亂。所謂標準狀態是指在溫度T和標準壓力 (100kPa)下物質的特定狀態,簡稱標準態。熱力學數據表中的標準態,國際上都已有明確規定。
對於反應物計量係數之和等於生成物計量係數之和的反應,其經驗平衡常數是無量綱的純數,與壓力、濃度所用的單位無關,而且也等於標準平衡常數之值。
對於反應物計量係數之和不等於生成物計量係數之和的反應,則其經驗平衡常數是有量綱的量,其數值就與壓力、濃度所用的單位有關。也只有當壓力、濃度的單位與熱力學數據表中對應標準態的單位相同時,所計算的經驗平衡常數數值才能與標準平衡常數數值相同。
催化劑
對於一個確定的可逆反應來說,由於反應前後催化劑的化學組成、質量不變,因此,無論是否使用催化劑,反應的始、終態都是一樣的,則反應的標準吉布斯函式變化是相等的,催化劑對化學平衡無影響。也就是說,催化劑只是改變了化學反應的動力學途徑,而熱力學卻僅僅關注變化的始、終兩態。
一個化學反應採用同一種催化劑,可以同等程度改變正、逆反應速率,而使化學平衡保持原有的狀態。因此,催化劑對化學平衡常數亦無影響。
影響因素
在中學階段,通常認為化學平衡常數隻與溫度有關,吸熱反應平衡常數隨溫度升高而增大,放熱反應則相反。但是嚴格說來,化學反應平衡常數是溫度與壓力的函式,對於不同的化學平衡常數,其情況也有所不同。
在氣相反應中,所有的標準平衡常數都只是溫度的函式。如果氣體是理想氣體,那么此時其經驗平衡常數也只是溫度的函式。但對於非理想氣體,平衡常數受溫度和壓力的共同影響。
理論上,只要有凝聚相(固體或者液體)參與的反應,都是溫度和壓力的函式。但是,在壓力變化範圍不大的情況下,可以忽略壓力對凝聚相體積變化的影響,即可以忽略壓力對平衡常數的影響。

