研究意義
可逆化學反應達到平衡時,每個產物濃度係數次冪的連乘積與每個反應物濃度係數次冪的連乘積成正比,這個比值叫做平衡常數。反應進行得越完全,平衡常數就越大。當一個可逆反應到達平衡時,生成物濃度之冪或分壓力的乘積與反應物濃度的冪(冪指數為對應物質的化學計量數)或分壓力的乘積之間的比值。用濃度計算的平衡常數以KC表示。用分壓力計算的平衡常數以KP表示。例如氨的合成:N2+3H2=2NH3在壓力(或各物質的濃度)不大時,平衡常數在溫度一定的情況下保持不變。從平衡常數的大小,可確定在該溫度下可逆反應中的正反應可能達到的程度。平衡常數不僅在分析化學和物理化學中有重要的理論意義,而且在化學工藝中一項重要的數據,可用以通過計算來確定生產條件。
化學反應
1.平衡常數是化學反應的特性常數。它不隨物質的初始濃度(或分壓)而改變,僅取決於反應的本性。一定的反應,只要溫度一定,平衡常數就是定值,其他任何條件改變都不會影響它的值。
2.平衡常數數值的大小是反應進行程度的標誌。它能很好地表示出反應進行的完全程度。一個反應的K值越大,說明平衡時生成物的濃度越大,反應物剩餘濃度越小,反應物的轉化率也越大,也就是正反應的趨勢越強。反之亦然。
濃度
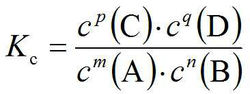 化學平衡常數表達式
化學平衡常數表達式1 平衡常數表達式表明在一定溫度下,體系達成平衡的條件。對於一般可逆反應mA+nB⇋pC+qD平衡時K=( (C)^p * (D)^q )/( (A)^m * (B)^n );其中:(C)(D)等表示 物質C、D的濃度;K是平衡常數;上述:在一定溫度下,可逆反應達到平衡時,生成物濃度冪的連乘積與反應物濃度冪的連乘積之比,是一個常數,冪指數為化學計量數改變溫
度,K的值會發生變化。
2 平衡狀態是化學反應在該條件下進行的最大限度。為了定量的研究化學平衡,必須找出平衡時反應系統內各組分的量之間的關係,平衡常數就是平衡狀態的一種數量標誌,是表明化學反應限度的一種特徵值。
標準平衡常數(Kθ):表達式中,溶質以相對濃度表示,即該組分的平衡濃度Ci除以標準濃度Cθ的商;氣體以相對分壓表示,即該組分的平衡分壓Pi除以標準分壓Pθ的商。以平衡時的生成物各組分的相對濃度和相對分壓之積為分子,反應物各組分的相對濃度和相對分壓之積為分母,各組分相對濃度或相對分壓的指數等於反應方程式中相應組分的計量係數。
相關試題
考查化學平衡常數的意義
1.在一定條件下,某可逆反應的K值越大,說明平衡體系中生成物所占的比例越大,它的正反應進行的程度越大,即該反應進行得越完全,反應物轉化率越大;反之,就越不完全,轉化率就越小。
2.當K>10^5或K<-10^5時,該反應就基本進行完全,一般當成非可逆反應;而K在-10~10之間的反應被認為是典型的可逆反應。
3.K值大小只能預示某可逆反應向某方向進行的最大限度,但不能預示反應達到平衡所需要的時間。
考查化學平衡常數的影響因素
1.平衡常數K只受溫度影響,既與任何一種反應物或生成物的濃度變化無關,也與壓強的改變無關;由於催化劑同等程度地改變正逆反應速率,故平衡常數不受催化劑影響。
2.任何可逆反應,當溫度保持不變,改變影響化學平衡的其它條件時,即使平衡發生移動,K值不變。
3.其它條件不變時,若正反應是吸熱反應,由於升高(或降低)溫度時平衡向正(或逆)反應方向移動,K增大(或減小);若正反應是放熱反應,由於升高(或降低)溫度時平衡向逆(或正)反應方向移動,K減小(或增加);所以溫度升高時平衡常數可能增大,也可能減小,但不會不變。