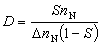多相催化動力學
正文
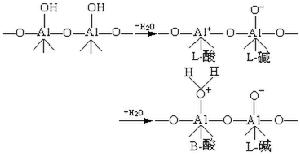
研究在相接觸面上發生的催化反應速率和反應機理的物理化學分支學科。多相催化反應大致可分為七個步驟:①反應物質從反應相穿過催化劑顆粒表面外的反應相膜,擴散到催化劑外表面;②反應物質從催化劑顆粒外表面通過毛細管擴散到催化劑內表面;③在催化劑內表面上被吸附;④在催化劑內表面上進行反應;⑤反應生成物在催化劑內表面上脫附;⑥生成物通過毛細管擴散到催化劑顆粒外表面;⑦生成物通過催化劑顆粒表面外的反應相膜擴散到反應相中。催化劑的活性和選擇性由催化劑的表面反應決定。表面反應機理 表面反應速率rs是催化劑表面上的反應物(或生成物)濃度隨時間的變化率,但表面濃度的測定方法尚不成熟,測定精確度較差,因此常用測定多相反應速率的方法求得。多相反應速率rh可由測定反應物(或生成物)濃度隨時間的變化來得到。但只有在反應體系穩定之後,實測的反應速率才能代表表面反應速率。
在理想條件下,表面反應機理有以下三種:
①在動力學區進行的單分子表面催化反應機理:
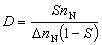
②兩種反應物分子都吸附在催化劑表面上進行反應的機理,稱朗繆爾-欣謝爾伍德機理:
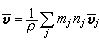
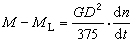
③在催化劑表面吸附的分子A與反應相中分子B反應生成P的機理:
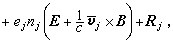
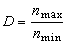
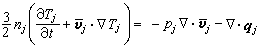
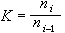
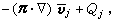
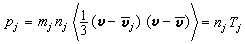
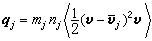
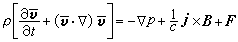
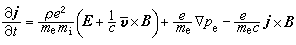
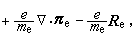 ,
,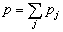 為反應物A的初始濃度。
為反應物A的初始濃度。 經驗動力學方程 上述反應速率方程是在表面均勻,不受擴散制約,吸附分子不解離的前提下給出的。但實際上催化劑的表面不均勻,同種分子在不同晶面上的催化活性和吸附熱不同,吸附熱隨表面覆蓋度的增加而下降,有擴散制約和分子間相互作用。因此,反應速率方程更複雜,有些只能用經驗方程。
對A+B─→R+S反應,若正反應速率大於逆反應速率,p為物質濃度或壓力,k+1、k-1為正逆反應速率常數,則反應速率
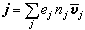 。若不能忽略逆反應,則r=
。若不能忽略逆反應,則r=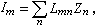 …。通過實驗可求出a、b、l、m、a′、b′、l′、m′。
…。通過實驗可求出a、b、l、m、a′、b′、l′、m′。 擴散制約的反應 流體在多孔催化劑中的擴散分為三種。容積擴散是在孔徑較大、氣體較密集時發生的。容積擴散係數
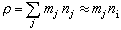 ,堸為分子平均速率,λ為分子平均自由程。微孔擴散是在孔徑較小、氣體密度低時發生的。微孔擴散係數
,堸為分子平均速率,λ為分子平均自由程。微孔擴散是在孔徑較小、氣體密度低時發生的。微孔擴散係數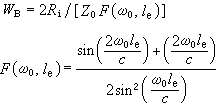 ,R為孔半徑。表面擴散是由於被吸附分子由高濃度向低濃度的熱運動擴散而產生的。表面擴散係數為
,R為孔半徑。表面擴散是由於被吸附分子由高濃度向低濃度的熱運動擴散而產生的。表面擴散係數為 。可以看出,表面擴散主要取決於擴散溫度T和表面活化能ES。
。可以看出,表面擴散主要取決於擴散溫度T和表面活化能ES。 擴散成為控制步驟的反應稱擴散區反應,又可分為外擴散區反應和內擴散區反應。表面反應成為控制步驟的反應稱動力學區反應,又可分為外動力學區反應和內動力學區反應。
①外擴散制約的反應的反應速率方程為:
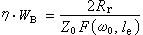
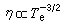 ;ρ 為氣體密度;μ為氣體粘度;D為氣體擴散係數;ρg為顆粒相對密度;u為催化劑床層中氣體的表面線速度;dp為催化劑球形顆粒直徑;ch為氣相中反應物濃度;ε為孔隙率。
;ρ 為氣體密度;μ為氣體粘度;D為氣體擴散係數;ρg為顆粒相對密度;u為催化劑床層中氣體的表面線速度;dp為催化劑球形顆粒直徑;ch為氣相中反應物濃度;ε為孔隙率。 ②內擴散制約的反應:
擴散係數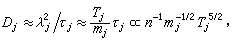
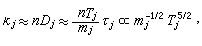 稱蒂勒模數;R為球顆粒半徑;ki為本徵速率常數;De為孔中反應物有效擴散係數;s為比表面;rp為內擴散制約的反應速率;rS為球形催化劑顆粒表面上的一級反應速率。
稱蒂勒模數;R為球顆粒半徑;ki為本徵速率常數;De為孔中反應物有效擴散係數;s為比表面;rp為內擴散制約的反應速率;rS為球形催化劑顆粒表面上的一級反應速率。 當η=1時,比反應速率(每克催化劑上的反應速率)r為:
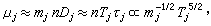
③表面擴散制約的反應,當反應氣體分子已進入微孔擴散時,表面擴散對催化影響很小。若反應分子大,催化劑孔徑小,二者接近同一數量級,則表面擴散對反應活性影響很大。
多相催化反應條件的最佳化 最優轉化率 高轉化率可提高原料利用率,但增加了催化劑用量,須增加反應器容積和空間速率。在生產能力、溫度、壓力和初始濃度固定時,轉化率、空間速率、反應器容積三者只有一個可任意選擇。
最優反應溫度 對於不可逆反應,溫度只對反應速率有影響,其影響服從阿倫尼烏斯方程。對於可逆吸熱反應,平衡常數K和反應速率常數k 均隨溫度升高而增大。對於可逆放熱反應,溫度增加,轉化率降低,但反應速率增加,因而淨反應速率隨溫度的變化有一最優值。
最優反應壓力 對於氣相反應:
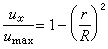
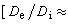 。壓力對平衡轉化率的影響為:Δv>0時,壓力提高,轉化率下降;Δv<0時,壓力提高,轉化率增加;Δv=0時,壓力對轉化率無影響。壓力對反應速率的影響為:對於擴散控制的反應,壓力直接影響反應速率;對於動力學控制的反應,壓力不大時,對吸附平衡和反應速率常數的影響可忽略不計。
。壓力對平衡轉化率的影響為:Δv>0時,壓力提高,轉化率下降;Δv<0時,壓力提高,轉化率增加;Δv=0時,壓力對轉化率無影響。壓力對反應速率的影響為:對於擴散控制的反應,壓力直接影響反應速率;對於動力學控制的反應,壓力不大時,對吸附平衡和反應速率常數的影響可忽略不計。 最優反應物濃度 對於
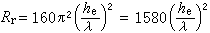 反應,當反應接近平衡時,最優濃度
反應,當反應接近平衡時,最優濃度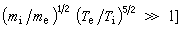 ;當反應遠離平衡時,最優濃度
;當反應遠離平衡時,最優濃度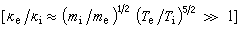 ;當反應在遠離平衡和接近平衡之間時:
;當反應在遠離平衡和接近平衡之間時: 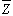
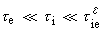 中之相應符號,nL為控制步驟的化學計算數。
中之相應符號,nL為控制步驟的化學計算數。