加氫
正文
氫與其他化合物相互作用的反應過程,通常是在催化劑存在下進行的。加氫反應屬還原的範疇。沿革 1897年,法國人P.薩巴蒂埃首先研究了不飽和有機化合物在鎳催化劑存在下的加氫反應。1902年,在德國建成了第一套加氫工業裝置,把具有不飽和碳碳雙鍵的液態油脂,在鎳催化劑存在下,經過加氫過程生產飽和的固態脂。1904年,俄國的Β.Н.伊帕季耶夫提出在加壓下進行加氫過程。此後,加氫過程的套用獲得迅速的發展。1913年,用哈伯-博施法(見合成氨工業發展史)由氫氣和氮氣合成氨。1923年,先後開發了用費托法由氫和一氧化碳合成液體燃料(見費托合成),和由一氧化碳高壓加氫合成甲醇等方法。1926年,用柏吉斯法由煤加氫液化(見煤直接液化)製取液體燃料。60年代以後,煉油廠廣泛採用加氫精制工藝,以提高油品質量。現在,加氫過程已是化學工業和石油煉製工業中最重要的反應過程之一。
反應類型 加氫過程可分為兩大類:①氫與一氧化碳或有機化合物直接加氫,例如一氧化碳加氫合成甲醇:
CO+2H2─→CH3OH
苯加氫制環己烷: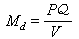
NC(CH2)4CN+4H2─→H2N(CH2)6NH2
②氫與有機化合物反應的同時,伴隨著化學鍵的斷裂,這類加氫反應又稱氫解反應,包括加氫脫烷基、加氫裂化、加氫脫硫等。例如烷烴加氫裂化: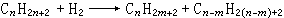
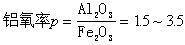
RSH+H2─→RH+H2S
加氫催化劑 主要有四類:①金屬催化劑,常用的是第八族過渡元素,如骨架鎳、鎳-硅藻土、鉑-氧化鋁、鈀-氧化鋁等。這類催化劑活性高,幾乎可用於所有官能團的加氫。②金屬氧化物催化劑,如氧化銅-亞鉻酸銅、氧化銅-氧化鋅、氧化銅-氧化鋅-氧化鉻、氧化銅-氧化鋅-氧化鋁等,主要用於醛、酮、酯、酸以及一氧化碳等化合物的加氫。③金屬硫化物催化劑,如鎳-鉬硫化物、鈷-鉬硫化物、硫化鎢、硫化鉬等,通常以γ-氧化鋁為載體,主要用於含硫、含氮化合物的氫解反應,部分硫化的氧化鈷-氧化鉬-氧化鋁催化劑常用於油品的加氫精制。④絡合催化劑,如RhCl【P(C6H5)3】3,主要用於均相液相加氫。
過程條件 加氫反應是可逆、放熱和分子數減少的反應,根據呂·查德里原理,低溫、高壓有利於化學平衡向加氫反應方向移動。加氫過程所需的溫度決定於所用催化劑的活性,活性高者溫度可較低。對於在反應溫度條件下平衡常數較小的加氫反應(如由一氧化碳加氫合成甲醇),為了提高平衡轉化率,反應過程需要在高壓下進行,並且也有利於提高反應速度。採用過量的氫,不僅可加快反應速度和提高被加氫物質的轉化率,而且有利於導出反應熱。過量的氫可循環使用。
常用的加氫反應器有兩類:一類用於高沸點液體或固體(固體需先溶於溶劑或加熱熔融)原料的液相加氫過程,如油脂加氫、重質油品的加氫裂解等。液相加氫常在加壓下進行,過程可以是間歇式的,也可以是連續的。間歇液相加氫常採用具有攪拌裝置的壓力釜或鼓泡反應器。連續液相加氫可採用涓流床反應器或氣、液、固三相同向連續流動的管式反應器。另一類反應器用於氣相連續加氫過程,如苯常壓氣相加氫制環己烷、一氧化碳高壓氣相加氫合成甲醇等,反應器的類型可以是列管式或塔式。
在高溫、高壓下,氫與鋼材中的碳原子能化合生成甲烷,使鋼材變脆,稱為氫蝕。故高壓加氫的反應器,必須採用合金鋼材。氫是易燃、易爆物質,加氫過程必須考慮安全措施。
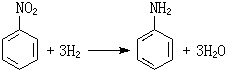
工業套用 加氫過程在石油煉製工業中,除用於加氫裂化外,還廣泛用於加氫精制,以脫除油品中存在的含氧、硫、氮等雜質,並使烯烴全部飽和、芳烴部分飽和,以提高油品的質量。在煤化工中用於煤加氫液化製取液體燃料。在有機化工中則用於製備各種有機產品,例如一氧化碳加氫合成甲醇、苯加氫制環己烷、苯酚加氫制環己醇、醛加氫制醇、萘加氫制四氫萘和十氫萘(用作溶劑)、硝基苯加氫還原制苯胺等。此外,加氫過程還作為化學工業的一種精製手段,用於除去有機原料或產品中所含少量有害而不易分離的雜質,例如乙烯精製時使其中雜質乙炔加氫而成乙烯;丙烯精製時使其中雜質丙炔和丙二烯加氫而成丙烯;以及利用一氧化碳加氫轉化為甲烷的反應,以除去氫氣中少量的一氧化碳等。