計算方法
如 aA+bB=cC+dD
α(A)=(A的初始濃度-A的平衡濃度)/A的初始濃度*100%=(c0(A)-【A】)/c0(A)*100%
常見等效平衡中轉化率變化
(一)當反應物的量不變,改變壓強或者溫度,若平衡向正反應方向移動時,反應物的轉化率都將提高。
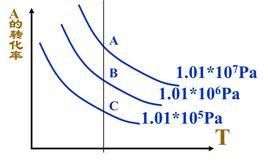
例如:N(g)+3H(g)=2NH(g) ΔH <0
當壓強增大或溫度降低時,N和H的轉化率都增大。
(二)當反應物的量改變,在固定容積中,則反應物的濃度也改變
(1)若反應物只有一種,如aA(g)=bB(g)+cC(g)
增加A的量,平衡向正反應方向移動,則反應物A的轉化率的變化與化學計量數有關,轉化率可能增大或者減 少或者不變。若按轉化率公式計算,分子、分母的值都增大,轉化率的值是不能確定的,而用壓縮原理可以解釋這三種轉化率的變化。
若a=b+c,平衡不移動,轉化率不變。
若a>b+c,平衡向正反應方向移動,反應物的轉化率增大。此時的平衡與原平衡不再是等效平衡。
若a<b+c,平衡向逆反應方向移動,反應物的轉化率減小。此時的平衡與原平衡不再是等效平衡。
注意:此處所說的平衡方向移動不一定為平衡實際移動方向,而是使用壓縮原理思考的結果
(2)若反應物不止一種時,如aA(g)+bB(g)=cC(g)+dD(g)
①若只增加A的量,平衡向正反應方向移動,B的轉化率增大,A的轉化率減小。
②若按原比例同倍數地增加反應物A和B的量,平衡向正反應方向移動,而反應物的轉化率與化學計量數有關。
如a+b=c+d,AB的轉化率不變。(用壓縮原理解釋是同樣道理)。
如a+b<c+d,AB的轉化率都減小。(用壓縮原理解釋,此時的平衡與原平衡不再是等效平衡。)
如a+b>c+d,AB的轉化率都增大。(用壓縮原理解釋,此時的平衡與原平衡不再是等效平衡。)