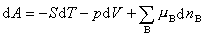亥姆霍茲函式
正文
又稱自由能。一種熱力學函式,符號為A,對任何熱力學系統來說,其定義為:A=U-TS (1)
式中U為系統的內能;T為系統的熱力學溫度;S為系統的熵。亥姆霍茲函式表示了系統的廣延量,它具有能量的量綱。在SI制中,它的單位是焦【耳】(J)。亥姆霍茲函式是一個導出熱力學函式。它是由德國的物理學家 H.von亥姆霍茲首先提出的。根據熱力學第二定律,如果一個封閉系統經歷一個等溫過程,則有:
ΔS-Q/T≥0(2)
式中 ΔS為該過程中系統的熵變;Q為該過程中系統的熱效應。根據熱力學第一定律和A的定義可得到:-ΔA≥W (3)
式中-ΔA 表示等溫過程中系統的亥姆霍茲函式的變化值;W表示該過程中系統對環境做的功(包括體積功和非體積功);不等號表示該過程為不可逆過程;等號表示該過程為可逆過程。式(3)表明,在等溫過程中,一個封閉系統的亥姆霍茲函式減少值等於該系統在此過程中所能做的最大功。因此,有些熱力學書中將A稱為“功函”。如果在一個封閉系統中進行的是一個等溫、等容且不做非體積功的過程,則式(3)變為:
ΔA≤0(4)
式中等號表示該過程為可逆過程,不等號表示該過程為自發過程。式 (4)表明,在一個封閉系統中,一個等溫、等容且不做非體積功的過程總是自發地向著亥姆霍茲函式減小的方向進行,直到系統的亥姆霍茲函式達到一個最小值為止。因此在上述特定條件下,系統亥姆霍茲函式的變化可以作為過程方向的判斷依據。
由熱力學函式基本關係式:
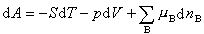 (5)
(5)
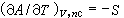 (6)
(6) 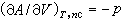 (7)
(7)
如果一個封閉系統經過一個等容過程,系統的亥姆霍茲函式的變化為ΔA,則根據式(6)可得:
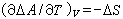 (8)
(8)
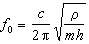 代入式(8),可得:
代入式(8),可得: 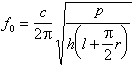 (9)
(9)