外觀氣味
氰化氫(HCN)是一種無色氣體,帶有淡淡的苦杏仁味。有趣的是,有四成人根本就聞不到它的味道,僅僅因為缺少相應的基因。氰化鉀和氰化鈉都是無色晶體,在潮濕的空氣中,水解產生氫氰酸而具有苦杏仁味。
存在套用
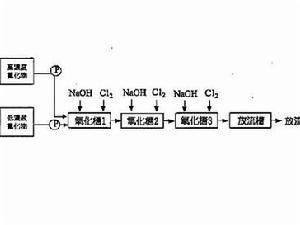 氰化物氧化系統流程圖
氰化物氧化系統流程圖 在發現HCN也存在於宇宙空間中的同時,據S Miller實驗指出它是通過放電從甲烷、氨、水生成胺基酸時的中間產物,因此認為它是生物以前的有機物生成中的重要中間產物。實際上,通過以氨和水溶液加熱而生成腺嘌呤,雖HCN在生物體內的存在並不多,但它可經苦杏仁苷酶水解而生成,能和金屬原子形成非常好的絡合物,因此易和金屬蛋白質結合,常常顯著地抑制金屬蛋白質的機能,尤其是對細胞色素C氧化酶,即使10-4M濃度,也會強烈地抑制,因而使呼吸停止。在高濃度時,和磷酸吡哆醛等的羰基結合,對以磷酸吡哆醛為輔酶的酶的作用可抑制。還因作用於二硫鍵,使之還原(-S-S-+HCN→-SH+NC-S),所以也能抑制木瓜蛋白酶(papain)的活性。人類的活動也導致氰化物的形成。汽車尾氣和香菸的煙霧中都含有氰化氫,燃燒某些塑膠和羊毛也會產生氰化氫。
套用領域
一般性工業:在廣義酸鹼理論中,氰離子(CN−)被歸類為軟鹼,故而可與軟酸類的低價重金屬離子形成較強的結合。工業中使用氰化物很廣泛。如從事電鍍、洗注、油漆、染料、橡膠等行業人員接觸機會較多。氰化物也被大量用於黃金開採中,因為金單質由於氰離子的絡合作用降低了其氧化電位從而能在鹼性條件下被空氣中的氧氣氧化生成可溶性的金酸鹽而溶解,由此可以有效地將金從礦渣中分離出來,然後再用活潑金屬比如鋅塊經過置換反應把金從溶液中還原為金屬。
紡織業:氰化物在有機合成中是非常有用的試劑。常用來在分子中引入一個氰基,生成有機氰化物,即腈。例如紡織品中常見的腈綸,它的化學名稱是聚丙烯腈。腈通過水解可以生成羧酸;通過還原可以生成胺等;可以衍生出其它許多的官能團來。
有機合成
 自動氰化物分析系統
自動氰化物分析系統 氰化物在有機合成中是非常有用的試劑。常用來在分子中引入一個氰基,生成有機氰化物,即腈。例如紡織品中常見的腈綸,它的化學名稱是聚丙烯腈。腈通過水解可以生成羧酸;通過還原可以生成胺,等等。可以衍生出其它許多的官能團來。
也用於安息香縮合,芳香醛在醇—水溶液中,在氰化鉀(劇毒)的作用下發生雙分子的縮合反應,生成α-羥酮(安息香,benzoin)。除芳香醛之外,某些不含有α-氫的脂肪醛也能發生同樣的反應。反應過程示意如下:近些年來,由於綠色化學的研究成就,本反應也可在非劇毒性的催化劑,如VB1等催化下進行。
中毒原理
其毒性跟CN離子對重金屬離子的超強絡合能力有關。CN主要跟細胞色素P450中的金屬離子結合,從而使其失去在呼吸鏈中起到的傳遞電子能力,進而使中毒者死亡。氰化物中毒一般都很迅速。臨床上常用的搶救方法是用硫代硫酸鈉溶液進行靜脈注射,同時使那些尚有意識的病人吸入亞硝酸異戊酯進行血管擴張來克服缺氧。常見的氰化物中毒原因是誤食含氰果仁兒,比如生桃仁兒等。中毒後會發出一種獨特的苦杏仁味。
中毒原因
無機和有機氰化物在工農業生產中套用廣泛,尤其是電鍍工業常用氰化物,故易獲得,常被用於自殺或他殺。民間常有食用大量處理不當或未經處理的苦杏仁、木薯而致意外中毒者。
毒理作用
 氰化物氧化系統流程圖
氰化物氧化系統流程圖 氰化物進入機體後分解出具有毒性的氰離子(CN-),氰離子能抑制組織細胞內42種酶的活性,如細胞色素氧化酶、過氧化物酶、脫羧酶、琥珀酸脫氫酶及乳酸脫氫酶等。其中,細胞色素氧化酶對氰化物最為敏感。氰離子能迅速與氧化型細胞色素氧化酶中的三價鐵結合,阻止其還原成二價鐵,使傳遞電子的氧化過程中斷,組織細胞不能利用血液中的氧而造成內窒息。中樞神經系統對缺氧最敏感,故大腦首先受損,導致中樞性呼吸衰竭而死亡。此外,氰化物在消化道中釋放出的氫氧離子具有腐蝕作用。吸入高濃度氰化氫或吞服大量氰化物者,可在2-3分鐘內呼吸停止,呈“電擊樣”死亡。
中毒量及致死量
口服氫氰酸致死量為0.7~3.5mg/kg;吸入的空氣中氫氰酸濃度達0.5mg/L
氰化物分析系統
即可致死;口服氰化鈉、氰化鉀的致死量為1~2mg/kg。成人一次服用苦杏仁40~60粒、小兒10~20粒可發生中毒乃至死亡。未經處理的木薯致死量為150~300g。此外很多含氰化合物(如氰化鉀、氰化鈉和電鍍、照相染料所用藥物常含氰化物)都可引起急性中毒。
臨床表現
大劑量中毒常發生閃電式昏迷和死亡。攝入後幾秒鐘即發出尖叫聲、發紺、全身痙攣,立即呼吸停止。小劑量中毒可以出現15~40分鐘的中毒過程:口腔及咽喉麻木感、流涎、頭痛、噁心、胸悶、呼吸加快加深、脈搏加快、心律不齊、瞳孔縮小、皮膚黏膜呈鮮紅色、抽搐、昏迷,最後意識喪失而死亡。
急性中毒臨床表現
(1)前驅期:口服中毒者有口、咽部灼熱感,噁心嘔吐、嘔吐物有苦杏仁味,同時伴有頭痛、頭昏、乏力、耳鳴、胸悶、大便緊迫感等。吸入中毒時可有眼、咽喉及上呼吸道刺激症狀。
(2)呼吸困難期:呼吸困難、脈快、兩側瞳孔先縮小後擴大,此後神志迅速模糊、昏迷。
(3)驚厥期:強直性或陣發性驚厥,甚至角弓反張、大小便失禁、意識喪失。
(4)麻痹期:全身肌肉鬆弛,反射消失,呼吸淺慢,最後呼吸、心跳停止。
屍檢所見
由於血中有氰化正鐵血紅素形成,故屍斑、肌肉及血液均呈鮮紅色。死亡迅速者,全身各臟器有明顯的窒息徵象。口服中毒者,消化道各段均可見充血、水腫,胃及十二指腸黏膜充血、糜爛、壞死,胃內及體腔內有苦杏仁味。吸入氰化物中毒死亡者,大腦、海馬、紋狀體、黑質充血水腫,神經細胞變性壞死,膠質細胞增生,心、肝、腎實質細胞濁腫。
解救措施
急性氰化物中毒的病情發展迅速,故急性中毒的搶救應分秒必爭,強調就地套用解毒劑。
1.口服中毒者,可用1:2000高錳酸鉀溶液洗胃,並刺激咽後壁誘導催吐洗胃;
2.吸入中毒者,應立即撤離現場、移至空氣新鮮、通風良好的地方休息;
3.用亞硝酸異戊酯1—2支擊碎後倒入手帕,放在中毒者的口鼻前吸入,每2分鐘一次,連用5—6次;
4.對症搶救。發生循環、呼吸衰竭者給予強心劑、升壓藥,呼吸興奮劑,吸氧,人工呼吸等;皮膚燒傷者,可用高錳酸鉀溶液沖洗,然後用硫化銨溶液洗滌;
5.經上述現場急救之後,應立即送醫院救治,切不可延誤。
亞硝酸鹽-硫代硫酸鈉治療法:
解毒機制
高鐵血紅蛋白形成劑如亞硝酸鹽可使血紅蛋白迅速形成高鐵血紅蛋白,後者三價鐵離子能與體內游離的或已與細胞色素氧化酶結合的氰基結合形成不穩定的氰化高鐵血紅蛋白,而使酶免受抑制。氰化高鐵血紅蛋白在數分鐘又可解離出氰離子,故需迅速給予供硫劑如硫代硫酸鈉,使氰離子轉變為低毒硫氰酸鹽而排出體外。
使用方法
立即將亞硝酸異戊酯1~2支(0.2~0.4ml)包在清潔的布內壓碎,給予吸入15~30秒鐘,5分鐘後可重複一次,總量不超過3支。小兒每次劑量為1支。本藥用後在體內只形成少量變性血紅蛋白,故僅作為應急措施。
3%亞硝酸鈉10~15ml靜注,每分鐘注入2~3ml。小兒給予6~10mg/kg。以上兩藥均能降低血壓,有循環障礙者慎用。
用同一針頭以同一速度注入25~50%硫代硫酸鈉20~50ml。小兒給予0.25~0.5g/kg。必要時一小時後重複半量或全量,以後酌情重複使用。輕度中毒者單用此藥即可。
檢驗過程
提取與淨化:由於氫氰酸及其鹽在酸性介質中極不穩定,易揮發,易分解,所以應及時進行檢驗。加之氰化物毒性大,致死量小,一般無須進行定量分析,故在定性分析時,生物樣品中的氰化物不經分離就可進行檢驗。
檢驗方法
1.原理:
氰離子在鹼性條件下,與硫酸亞鐵作用,生成亞鐵氰絡鹽,酸化後與三價鐵離子反應生成普魯士藍。
2.試劑:
 氰化物試劑
氰化物試劑 10%酒石酸溶液;30%硫酸;
硫酸亞鐵-氫氧化鈉試紙:將濾紙浸入新配製的10%硫酸亞鐵溶液中,取出晾乾後剪成小塊,臨用時加一滴10%氫氧化鈉即可。
3.檢驗:
取適量檢材搗碎,放入一100毫升錐形瓶中,加水成粥樣,用10%酒石酸酸化後,立即在瓶口蓋以硫酸亞鐵-氫氧化鈉試紙,然後用小火緩緩加熱,待瓶中溶液沸騰後,取下試紙浸入稀硫酸中,如有氰化物存在試紙即顯藍色斑點。
法律規定
中國《刑法》規定,未經國家有關部門批准,非法買賣儲存毒害性、放射性、傳染病病原體物質,危害公共安全的行為構成非法買賣危險物質罪。
其中“毒害性”物質範圍廣泛,如砒霜、鼠藥、氰化物、野蘑菇、肉毒桿菌等。非法買賣危險物質罪可處三年以上十年以下有期徒刑,情節嚴重的處十年以上有期徒刑,無期徒刑或死刑。
香港政府消防處把氰化物列作第四類危險品,任何人不得擅自買賣。
其他相關
一般而言,中毒後如果沒有採取有效的急救措施,除非劑量很低,否則死亡通常都在中毒後15分鐘至1小時內發生,具體的時間長短與毒藥劑量、中毒途徑都有關係。如果口服大量氰化物,或通過靜脈注射、吸入高濃度氫氰酸氣體的形式中毒,1-2分鐘後就會出現意識喪失、心跳驟停並導致死亡,算得上是“閃電式死亡”了。
相比之下,砒霜中毒大約需1小時方才出現症狀,且要等到數小時後甚至次日才會死亡,從而給醫生留下了充足的搶救時間。同時,砒霜的水溶性比氰化物要差很多,因而摻入酒水後容易沉澱下來而被人發現,這也是為什麼氰化物的“地位”要高於砒霜。
 氰化物
氰化物 不過就算氰化物不幸中毒,也並非無藥可救。現代醫學對此已經有了一套規範的搶救方案,如立即吸入亞硝酸異戊酯氣體(倒在手絹上捂住口鼻吸入),再靜脈注射亞硝酸鈉或亞甲基藍(又稱美藍)、4-二甲胺基苯酚、羥鈷氨素、硫代硫酸鈉等藥物解毒,並給予吸氧、呼吸機支持、高壓氧治療及利尿等輔助措施,往往能挽救中毒者的生命,國內外已有多起成功搶救氰化物中毒者的報導。
此外,由於氰化鉀、氰化鈉都需要在到達胃部後與胃酸發生反應並釋放出氰基離子,才能發揮其最大效用,因而僅僅從理論上說,如果足夠幸運,當含有氰化物的液體剛喝到嘴裡就發覺不對勁之後,立刻將其吐出來,是有可能倖免於死的。
不過,這種急救過程就是在和死神賽跑,服用的氰化物劑量越大,留給醫生的時間就越短,嚴重中毒的患者多數會死於送往醫院的途中。
世界十大致命毒藥
| 毒藥的正式研究開始於19世紀早期,標誌是生理學家克勞德伯納得研究馬錢子的藥效。 | |
| 武器——大規模殺傷性武器 >>>回到科學頻道 | |
| 肉毒桿菌 | 是一種生長在缺氧環境下的細菌,在罐頭食品及密封醃漬食物中具有極強的生存能力,是目前毒性最強的毒素之一。 |
| 蓖麻毒素 | 是一種具有兩條肽鏈的高毒性的植物蛋白。它主要存在於蓖麻籽中。由於其毒性強烈,診斷、治療困難,早在第一次世界大戰期間,美軍就將其作為侯選化學戰劑進行了廣泛研究,並曾生產了1700公斤的蓖麻毒素粗品。 |
| 炭疽 | 是由炭疽桿菌所致的人畜共患傳染病。原系食草動物(羊、牛、馬等)的傳染病,人因接觸這些病畜及其產品或食用病畜的肉類而被感染。 |
| 沙林毒氣 | 是一種劇毒神經毒劑,通過過度刺激肌肉和重要器官影響神經系統產生致命效果。 |
| 河豚毒素 | 是一種能麻痹神經的劇毒,通常只需氰化鉀五百分之一就可置人於死地的劇毒,中毒的人會因神經麻痹而窒息而死,其中,毒素直接進入血液中毒死亡速度最快。 |
| 氰化物 | 可分為無機氰化物,很多氰化物,凡能在加熱或與酸作用後或在空氣中與組織中釋放出氰化氫或氰離子的都具有與氰化氫同樣的劇毒作用。 |
| 汞中毒 | 汞中毒(mercurypoisoning)以慢性為多見,主要發生在生產活動中,長期吸入汞蒸氣和汞化合物粉塵所致。以精神異常、齒齦炎、震顫為主要症狀。 |
| 士的寧 | 又名番木鱉鹼,是由馬錢子中提取的一種生物鹼,能選擇性興奮脊髓,增強骨骼肌的緊張度,臨床用於輕癱或弱視的治療。 |
| 鵝膏毒素 | 來自於一種毒蘑菇,它可在幾天之內摧毀人們的肝和腎,人們會清醒的感受到來自於身體的極度疼痛,直至昏迷、死亡。 |
| 毒鼠強 | 是德國科學家在1949年首次合成的,化學名稱為“四亞甲基二碸四胺”,其毒性極大,被實驗動物食入後,毒物未達到胃裡毒性便發作,每1000克體重使用0.2毫克,幾分鐘即可死亡,且化學結構非常穩定,不易降解,可造成二次、三次中毒。 |
世界十大致命毒藥全揭秘
| 人類發現毒藥是一種偶然,可能是在做飯的時候發現了某些植物含有劇毒。然而具有毒藥知識的人在那個時候被尊為是部落的術士。第一份下毒殺人的記錄出現在基督時代的羅馬帝國,但在之前,印度人、中國人、希臘人、埃及人早已開始使用毒藥。埃及豔后就用奴隸來實驗天仙子、顛茄和亞薩普蛇毒(最後其自殺所選用的蛇)。甚至在很多國家有人一點一點的增加毒藥的食用量,以達到對它們的免疫,例如在大仲馬筆下的《基度山伯爵》中有類似的描寫。人類歷史上發明和發現了數不清的毒藥,美國科學雜誌近日就評出了世界十大致命毒藥: |