水溶液電解
正文
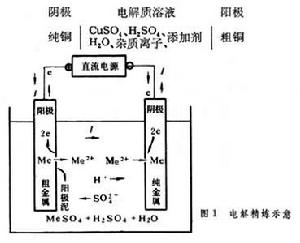
直流電通過電解質水溶液,在電極上發生化學反應的過程。電解反應為原電池反應的逆過程,也就是將電能轉變成化學能的過程。為了討論上的統一,規定電解槽中從外電路輸入電子(e)的電極為陰極,在此電極上進行還原反應;向外電路輸出電子的電極為陽極,在該電極上進行氧化反應。在冶金中廣泛套用水溶液電解作為金屬精煉和從浸取液回收金屬的重要手段。前者稱為電解精煉或可溶陽極電解;後者稱為電解提取或不溶陽極電解,也稱電沉積(或電積)。電解精煉 銅、鎳、鈷、金、銀等金屬大都用電解精煉製取;而鉛、錫等金屬既可用火法也可用電解進行精煉。此時以粗金屬作陽極,純金屬薄片作陰極(始極片),在適當的電解液中完成電解精煉作業,見圖1、表1。現以銅的電解精煉為例,說明此種電解的一般規律。電解體系可表示如下:直流電通過時,陽極中電極電勢比銅負的金屬,如鋅、鐵、鈷、鎳、砷等,優先失去電子而成為離子進入電解液。但是,這類雜質在經過火法精煉的陽極銅中含量很少,所以它們的電極反應不是主要反應。電極電勢比銅正的金屬,如金、銀,總的說來不能進行陽極溶解,而以金屬粒子形態落到電解槽底部或附著在陽極上,形成陽極泥,成為回收貴金屬的原料。因此陽極的主要反應是:
 水溶液電解
水溶液電解 水溶液電解
水溶液電解電解液中較正電性的離子將優先在陰極上得到電子,而以金屬形態析出。由於電解液中Cu2+的析出電勢較正,並且濃度也較大,因此陰極上的主要反應是:
Cu2++2e─→Cu 嗞°=0.34伏
結果使陰極銅的品位提高,達到精煉的目的。在一般電解時,由於Cu2+ 和雜質離子的濃度不斷升高,必須定期抽出一部分電解液淨化處理,同時補充純淨的硫酸以保持穩定的Cu2+及硫酸濃度,並使雜質離子的濃度不超過一定的限度。此外,必須往電解液中加入一種或數種添加劑,以改善陰極析出產品的表面狀態,常用的添加劑有動物膠、硫脲和乾酪素等。
電解提取 其特點是可以不經冶煉粗金屬的中間工序,直接獲得純金屬;由於使用了不溶陽極,在電解的同時,溶劑也得到再生,可返回做浸取液使用,電解槽見圖2。但是這種方法電流效率一般較低,電能消耗高。此法已廣泛用於鋅、銅、鎘的濕法冶金,在鎳、鈷、錳、鉻生產中也有使用的,其簡況可參考表2。電解提取的槽電壓必須大於電解液中要提取的金屬化合物的分解電壓,並隨電流密度的提高而增大。所以槽電壓 (E)就是使電解過程能順利進行所必須施加的外電壓。它總比可逆條件下測得的理論分解電壓(
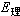 )大,並存在下列關係:
)大,並存在下列關係: 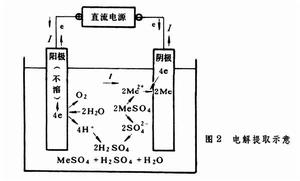 水溶液電解
水溶液電解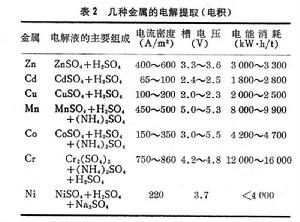 水溶液電解
水溶液電解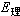 +|η+|+|η-|+
+|η+|+|η-|+ IR式中,|η+|、|η-|
IR式中,|η+|、|η-|分別為陽極和陰極的超電勢的絕對值;I為電流強度;R為包括電解液、接觸點、陽極泥等的電阻。由表可見,同種金屬電解提取的槽電壓和電能消耗都比電解精煉的大得多。
以鋅為例,說明電解提取的一般規律。淨化後含Zn2+為 110~130克/升的硫酸鋅中性水溶液以一定流量連續流入電解槽內。以鉛合金板作陽極,鋁板作陰極。兩極反應如下:
① 陰極反應,由於氫的標準電極電勢較鋅為正,在陰極可能發生下列反應:
Zn2++2e─→Zn 嗞°=-0.76伏
2H++2e─→H2 嗞°=0伏
在實際電解時,離子析出電勢(嗞)為:
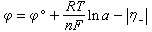
η啹=ɑ+blgdkɑ、b是與溫度和電極材料有關的常數;dk是陰極電流密度。η啹隨電流密度增大而提高,隨溫度的提高而降低。由於η啹的數值較大,使氫的析出電勢比鋅更負,所以不能大量析出氫。
② 陽極反應 在新的陽極上可能發生的反應有:
Pb─→pb2++2e (1)
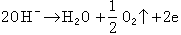 (2)
(2)
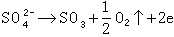 (3)
(3)
Pb2++SO厈 ─→PbSO4
Pb2+ ─→Pb4++2e
Pb(SO4)2+2H2O─→2H2SO4+PbO2
形成的PbO2沉積於陽極表面,起到保護層的作用,使陽極變為不溶陽極。反應 (3)不會發生。這樣在陽極上主要進行反應(2),放出氧氣。從電解槽流出的廢電解液中Zn2+ 的濃度降至50~55克/升,而H2SO4的濃度卻提高到135~155克/升。
近年來在電解工藝中開展的研究主要有:①提高電流密度、強化生產,主要途徑是改進電解槽結構和電解液的循環方式、周期反向電解和周期斷電電解等;②硫化物、合金直接電解和流態化電解及懸浮電解;③串聯電解等。
參考書目
趙天從主編:《重金屬冶金學》,上、下冊,冶金工業出版社,北京,1981。